Ферменты имеют белковую природу. Ферменты протеины и протеиды
Ферменты протеины - Справочник химика 21
На основании вышеизложенного можно сделать вывод, что все ферменты по своей химической природе делятся на две группы 1) однокомпонентные ферменты — протеины, представляющие собой простые кристаллические белки к ним относится большинство гидролитических ферментов 2) двухкомпонентные ферменты — протеиды, состоящие из активной группы и специфического коллоидного носителя к этой группе принадлежат в основном ферменты, катализирующие окислительно-восстано-вительные процессы. [c.520] I. Ферменты протеины построены из аминокислот, связанных между собой главными валентностями. Сюда относятся, например, пепсин, трипсин, папайи, карбоксипептидаза,, уреаза. [c.340]Большой интерес к названной группе антибиотиков связан с тем, что циклоспорины обладают специфическим иммуносу-прессорным действием. Циклоспорин А — это первый представитель нового поколения иммуномодуляторов. Указанное свойство циклоспоринов сделало возможным широкое применение их в медицинской практике при трансплантации отдельных органов и тканей, а также при лечении ряда аутоиммунных заболеваний (псориаз, ревматоидный артрит, пузырчатка, рассеянный склероз и др.). Это позволило глубже познать механизм различных иммунных реакций. Установлено, что циклоспорин в Т-лим-фоцитах связывается с Са -зависимым белком (кальмодулином), в результате чего тормозится взаимодействие фермента протеин-киназы с ионами кальция. [c.387]
По строению молекулы ферменты подразделяются на одно- и двухкомпонентные. Первые представляют собой простые белки — протеины. На отдельных участках мО лекулы ферментов-протеинов в результате определенного пространственного расположения остатков амино-I кислот создаются так называемые активные центры, в, которых протекают каталитические реакции. Активные [c.53]
Различают ферменты - простые белки, которые при гидролизе дают только аминокислоты. Ферменты-протеины используются в качестве лекарственных и диагностических средств (пепсин, трипсин, папаин, уреаза). Сложные ферменты, как правило, имеют простетическую группу (кофермент) небелковой природы, связанную с белком фермента связью различной степени прочности. Роль коферментов в общем механизме биокатализа настолько важна, что их можно рассматривать как отдельную группу биологически активных веществ с разными механизмами действия. [c.204]
Многие ферменты (протеины-катализаторы) нормально функционируют только в присутствии липидов [6]. Это подтверждается деактивацией и активацией удаления и замещения фосфолипидов. Взаимодействия протеинов с липидами охватывает область от ковалентных связей до ионных и гидрофобных взаимодействий. Можно предположить, что растворимость влияет на стабильность некоторых конформаций, которые, в свою очередь, обусловливают повышенную активность ферментов. [c.327]
Кроме активных групп (ферменты — протеиды) или активных центров (ферменты — протеины) биокатализаторы имеют субстратный центр — участок ответственный за присоединение субстрата к ферменту и аллостерический центр, при присоединении к которому изменяется третичная структура белковой молекулы. Это присоединение приводит к изменению конфигурации активного центра и, как следствие, к увеличению или уменьшен лиго каталитической активности фермента. [c.40]
Из имеющихся гипотез, по нашему мнению, наибольший интерес представляет гипотеза Уэйна, которая допускает возможность как химического взаимодействия с различными ферментами, протеинами и другими молекулами, так и пространственного блокирования различных процессов. [c.384]
Ферменты протеины. Оказалось невозможным разложить ферменты протеины на активную группу и белок. Поэтому полагают, что активными группами в них являются или сочетание аминокислот между собой, или те или иные аминокислоты, или, наконец, отдельные группы в аминокислотах, как, например, гидроксильная группа тирозина в пепсине, который особенно богат этой аминокислотой. [c.340]
По строению молекулы ферменты подразделяются на одно- и двухкомпонентные. Первые представляют собой простые белки — протеины. На отдельных участках молекулы ферментов-протеинов в результате определенного пространственного расположения остат- [c.51]
Этот вопрос изучался во многих крупнейших современных лабораториях. В результате многочисленных и весьма трудоемких и кропотливых работ было установлено, что большинство гидролитических ферментов от-гюсится к классу простых белков — протеинов. Действительно, при гидролизе этих ферментов, как и при гидролизе белков (стр. 24), ничего, кроме аминокислот, получить не удается. К такого рода ферментам — протеинам, близким по своим физико-химическим свойствам к глобулинам, относятся, в частности, пепсиноген, пепсин, трипсиноген, трипсин, папаин, уреаза и ряд других. С другой стороны, ферменты, катализирующие окислительновосстановительные процессы, обычно принадлежат к числу сложных белков, т. е. протеидов. В состав молекулы этих ферментов, помимо белковой части, входят различные термостабильные соединения, например нуклеотиды, порфириновые циклы, атомы железа, меди и т. д. Эти небелковые группы, как и небелковые компоненты других протеидов, называются простетическими группами. [c.128]
Пример трудностей, связанных с дифференциальной емкостью, представлен Майерсом и Остеръянгом [31]. На рнс. 6.20, а показаны дифференциальные импульсные кривые 1 М НС1 в присутствии и в отсутствие 20 мкг/л As . На рис. 6.20,6 представлены полярограммы растворов, содержащих дополнительно поверхностно-активное вещество Тритон Х-100 (0,001%). As восстанавливается необратимо, поэтому на высоту пика может сильно влиять адсорбция поверхностно-активного вещества. Тритон Х-ЮО изменяет и дифференциальную е.мкость и вследствие этого ток заряжения. Если фоновая кривая изменяется неизвестным и непредсказуемым образом, то использование градуировочной кривой для определения вещества является конечно сомнительным. Влияние поверхностно-активных веществ на ток фона, кроме того, иллюстрируется рис. 6.21. Растворы пептона готовят из обработанных ферментом протеинов, они представляют довольно упрощенную модель аналитического образца со сложной матрицей поверхностно-активных соединений. Изменение тока заряжения должно серьезно мешать многим определениям. [c.412]
Таким образом, какой-либо трансгенный сорт растения отличается от исходного только тем, что в его генетическом материале к 25 — 30 тысячам существующих генов добавлен относительно небольшой фрагмент ДНК, в котором записана информация об одном-двух новых генах и их регуляторных элементах. Активность тих добавленных генов в организме выражается в биосинтезе одного-двух новых для организма протеинов (ферментов или структурных белков). Поскольку генетическая инженерия может оперировать любыми генами, существующими в природе, а не только генами от организмов, состоящих в эволюционном родстве с отдельными видами культурных растений, как это делается в традиционной селекции, то продукты привнесенных генов (ферменты, протеины) могут выглядеть в генетически модифицированном организме как необычные, несвойственные, чужеродные для данного вида, которые в природе у него не встречаются. Соответственно именно продукты трансгенов являются наиболее существенными, осязаемыми факторами рисков, связанных с генно-инженерными организмами. [c.63]
В процессе поспрансляционной модификации остатки глутаминовой кислоты в N-концевых участках молекул факторов II, VII, IX, X превращаются в у-карбоксиглутаминовую кислоту. Фермент протеин-карбоксилаза, который карбоксилирует остатки глу- [c.321]
chem21.info
Ферменты-протеиды.Понятие апофермента,кофактора,холофермента.
Опубликовано в Биохимия. Ответы на вопросы к екзамену.
Ферменты – белковые вещества,ускоряющие скорость химических реакций в живых организмах.Известно,что вещества,ускоряющие течение химических реакций называются катализаторами,но по аналогии с этим ферменты считаются биологическими катализаторами,поскольку они действуют в живой материи. По строению все ферменты можно разделить на однокомпонентные (простые, или ферменты-протеины) и двухкомпонентные (сложные, или ферменты-протеиды). Ферменты-протеины построены по типу простых белков – состоят только из аминокислот. Ферменты-протеиды состоят из белковой части – апофермента и небелковой части – кофактора. Апофермент обуславливает субстратную специфичность, т.е. играет роль субстратного участка АЦ, а кофермент играет роль каталитического участка АЦ, т.е. обуславливает специфичность действия.Апофермент и кофакторы порознь мало активны или вообще неактивны как катализаторы;объединение их вместе дает активную молекулу фермента,которая называется полным ферментом или холоферментом. В роли кофактора могут выступать ионы металлов или сложные органические соединения. Иногда для каталитической активности необходимо наличие тех и других. Известны сотни ферментов, для функционирования которых требуются кофакторы. Однако количество металла и коферментов в организме ограничено.Кофакторы обычно термостабильны, тогда как большинство ферментов при нагревании инактивируется. Кофакторы с ферментом связываются с разной степенью сродства. Чаще всего кофактор можно отделить от ферментного белка путем диализа или каким-либо другим способом. Но существуют кофакторы весьма прочно связанные с белком и отделяющиеся лишь при денатурации фермента. Пример, супероксиддисмутаза -фермент, который содержит ионы 2-х металлов: по одному иону Cu2+ и Zn2+ в каждой из ее двух субъединиц; металлы трудно отделяются без нарушения конформации (белка) фермента. Причем апофермент может снова взаимодействовать с обоими метталами, при этом регенерируется холофермент.Ионы металлов как кофакторы.Кофакторами ферментов могут быть различные ионы металлов, например, Cu2+, Cu3+ , Zn2+, Mg2+, Mn2+, Fe2+, Fe3+. K+, Na+. Ионы металлов как кофакторы ферментов могут выполнять одну из возможных функций:1) могут служить мостиком, связывающим фермент с субстратом в результате образования координационного комплекса.2) могут выполнять каталитическую функцию. Пример, каталаза, которая катализирует разложение перекиси водорода, атом железа играет роль каталитического центра.3) Металлы могут участвовать в поддержании нативной конформации фермента. В этом случае их часто называют активаторами.Органические соединения - как кофакторы .Сложные органические соединения, играющие роль кофактора фермента, принято называть коферментами. Коферменты принимают непосредственное участие в ферментативной реакции часто как переносчики химических групп. Коферменты определяют природу катализируемой ферментом реакции.Кофермент присоединен к белковой части (апоферменту) либо ковалентно, либо при участии целого ряда более слабых сил (водородная связь, гидрофобные взаимодействия, ион-ионные взаимодействия и т.д.)
biohimist.ru
5. Ферменты
Ферменты – это биологические катализаторы белковой природы, образуемые живой клеткой. Ускоряя многочисленные реакции, протекающие в живом организме, ферменты являются движущей силой обмена веществ.
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов, так же как неорганических катализаторов, заключается:
в активации молекул реагирующих веществ;
в разбиении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.
Ферменты являются белками, обладают третичной и четвертичной структурой и имеют все свойства белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
Простые ферментысостоят только из аминокислот – например,пепсин,трипсин,лизоци,папаин, уреаза, рибонуклеаза, фосфатаза и др.
Сложные ферменты(холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот –апофермент, и небелковую часть –кофактор. Кофактор, в свою очередь, может называтьсякоферментом илипростетической группой. Примером могут бытьсукцинатдегидрогеназа (в цикле трикарбоновых кислот),аминотрансферазы (содержат пиридоксальфосфат) (функция),пероксидаза (содержит гем). Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут.
Все ферменты в зависимости от типа катализируемой реакции подразделяются на 6 классов:
Оксидоредуктазы– катализируют окислительно - восстановительные реакции.
Трансферазы– катализируют реакции переноса различных химических групп с одной молекулы на другую.
Гидролазы– катализируют реакции гидролиза.
Лиазы– катализируют реакции отщепления от субстратов негидролитическим путем той или иной химической группы с образованием двойной связи или присоединение химической группы по месту двойной связи.
Изомеразы – катализируют реакции изомеризации органических соединений.
Лигазы, или синтетазы– катализируют реакции синтеза веществ, сопровождающиеся расщеплением высокоэнергетической связи в молекуле АТФ или аналогичного нуклеозидтрифосфата.
Контрольные задания
Что такое ферменты?
Какова природа ферментов?
Приведите примеры ферментов протеинов.
Приведите примеры ферментов протеидов.
Какие факторы влияют на ферментативную активность?
Что такое специфичность фермента? Назовите виды специфичности.
Приведите примеры субстратной специфичности.
Приведите примеры групповой (относительной) специфичности.
Приведите примеры стереоспецифичности.
Что такое активный центр фермента?
Какую модель взаимодействия фермента и субстрата предложил Фишер?
Что такое модель индуцированного соответствия?
Какова последовательность событий в ходе ферментативного катализа?
Что понимают под активностью фермента?
Что такое ингибиторы?
Назовите типы ингибирования.
Каков механизм специфического необратимого ингибирования? Приведите примеры.
Каков механизм неспецифического необратимого ингибирования? Приведите примеры.
Что такое конкурентное ингибирование? Приведите примеры.
Что такое аллостерический центр?
Каков механизм аллостерического ингибирования? Какова его роль? Приведите примеры.
Что такое активаторы? Как ионы металлов активируют фермент?
Какова роль ионов металлов в катализе?
Какими способами регулируется активность ферментов?
На чем основана классификация ферментов?
Как используются ферменты в медицине, сельском хозяйстве и научных исследованиях? Приведите примеры.
studfiles.net
Ферменты имеют белковую природу - Биохимия
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем), лактатдегидрогеназа (содержит Zn2+), амилаза (содержит Ca2+).
Кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+).
Деление на коферменты и простетические группы не всегда однозначно:• если связь кофактора с белком прочная, то в этом случае говорят о наличии простетической группы,• но если в качестве кофактора выступает производное витамина - то его называют коферментом, независимо от прочности связи.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами, т.е. состоять из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
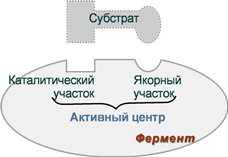 Схема строения ферментов
Схема строения ферментов У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
 Схема формирования сложного фермента
Схема формирования сложного фермента 2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
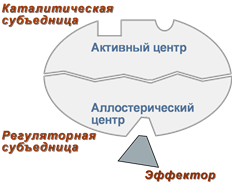 Схема строения аллостерического фермента
Схема строения аллостерического фермента В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см "Регуляция активности ферментов").
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скорости катализируемой реакции, разной чувствительности к ингибиторам и активаторам, условиям работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы.
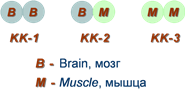 Изоферменты креатинкиназы
Изоферменты креатинкиназы
|
 Изоферменты лактатдегидрогеназы
Изоферменты лактатдегидрогеназы
|
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (h4M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (h2M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (h3M2).
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами "туннель". В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
 Строение мульферментного комплекса
Строение мульферментного комплекса Например,
Абзимы
Абзимами называются антитела, имеющие каталитическую функцию (англ. abzymes, antibodies as enzymes) и катализирующие конкретные реакции. Такая способность возникает в результате формирования промежуточного продукта при связывании антитела с антигеном (имитация переходного комплекса E-X ферментативной реакции).
Вы можете спросить или оставить свое мнение.
biokhimija.ru
1.10.2. Сложные белки (протеиды)
К сложным белкам (протеидам) относят белки, в которых помимо белковой части содержатся небелковые вещества (простетические группы).
Сложные белки классифицируют по химическому составу их простетической группы.
Выделяют следующие группы сложных белков:
1. хромопротеиды;
2. нуклеопротеиды;
3. липопротеиды;
4. гликопротеиды;
5. фосфопротеиды;
6. металлопротеиды
Хромопротеиды
Хромопротеиды содержат в качестве простетической группы окрашенные небелковые соединения. В группе хромопротеидов выделяют гемопротеиды и флавопротеды.
В гемопоротеидахпростетической группой является гем – органическое, железосодержащее вещество, придающее белку красный цвет. Гем соединяется с белком глобином за счёт координационных и гидрофобных связей. Примерами гемопротеидов являются белок эритроцитов гемоглобин, белок мышц миоглобин, тканевые белки цитохромы, ферменты каталаза, пероксидаза. Гемопротеиды участвуют в переносе кислорода и в окислительных процессах в тканях.
В флавопротеидах содержится простетическая группа жёлтого цвета. В качестве простетической группы могут быть представлены нуклеотиды ФАД, ФМН. К флавопротеидам относится фермент сукцинатдегидрогеназа. Некоторые флавопротеиды содержат в своём составе металлы – металлофлавопротеиды. Флавопротеиды участвуют в окислительных процессах в организме.
Нуклеопротеиды
Нуклеопротеиды состоят из белковой части и нуклеиновых кислот: ДНК или РНК. В ядре локализованы дезоксирибонуклеопротеиды, в цитозоле – рибонуклеопротеиды. Белки в нуклепротеидах ядра представлены в основном гистонами. Белковая и небелковые части нуклеопротеидов связаны ионными и гидрофобными связями. При полном гидролизе нуклеопротеидов образуются аминокислоты, фосфорная кислота, углевод и пуриновые или пиримидиновые азотистые основания. Нуклеопротеиды участвуют в хранении и воспроизведении генетической информации.
Липопротеиды
Липопротеиды в качестве простетической группы содержат различные липиды (триацилглицерины, фосфолипиды, холестерин и др.). Между белком и липидом формируются гидрофобные и ионные связи. Липопротеиды принято делить на структурные, входящие в состав клеточных мембран, и транспортные, осуществляющие перенос липидов кровью. Транспортные липопротеиды представляют собой сферические частицы, внутри которых находятся гидрофобные жиры, а на поверхности – фосфолипиды и гидрофильные белки. Примером липопротеида может служить фактор свёртывания крови – тромбопластин.
Фосфопротеиды
Фосфопротеиды содержат остатки фосфорной кислоты, соединённые с радикалами остатков серина, реже треонина белковой части сложноэфирными связями. Присоединение фосфорной кислоты к белку может носить обратимый характер и сопровождаться формированием или разрывом ионных связей фосфорной кислоты и заряженных групп белка, что меняет структуру и биологическую активность фосфопротеида. К фосфопротеидам относятся структурные белки костной ткани, казеиноген молока, ововителлин белка куриного яйца, некоторые ферменты (фосфорилаза, гликогенсинтетаза, ТАГ-липаза).
Гликопротеиды
Гликопротеиды содержат, как правило, прочно присоединенные гликозидными связями остатки углеводов (моносахаридов, олигосахаридов). Гликопротеиды обычно имеют мозаичную структуру, в которой чередуются углеводные и белковые фрагменты.
Углеводная часть придаёт специфичность гликопротеидам и определяет их устойчивость к тканевым ферментам. Гликопротеиды широко представлены в организме человека. Они содержатся как в тканях, так и в биологических жидкостях. Муцин слюны содержит в своём составе до 15% маннозы и галактозы. Гликопротеидами являются некоторые гормоны, например, гонадотропины гипофиза. Некоторые транспортные белки крови относятся к гликопротеидам (трансферрин). Гликопротеидом является фактор свёртывания крови фибриноген, Все виды иммуноглобулинов содержат углеводные фрагменты. Углеводы придают специфичность тканевым рецепторам. Адгезивные белки (фибронектин, ламинин), будучи гликопротеидами, обеспечивают взаимодействие клеток, волокон, гликозаминогликанов соединительной ткани.
Металлопротеиды
Металлопротеиды –сложные белки, в состав которых входят металлы. Например, гемосидерин и ферритин содержат железо, фермент алкогольдегидрогеназа содержит цинк.
В последнее время предложена классификация белков на семейства - группы близких по структуре и функциям белков, имеющие гомологичные последовательности аминокислот. Например, выделяютсемействосериновых протеаз, содержащих в активном центре аминокислоту серин и участвующих в расщеплении различных белков. В это семейство входят трипсин, химотрипсин, эластаза, многие ферменты свёртывания крови (тромбин), антисвёртывающей системы (фибринолизин).Семейство иммуноглобулиноввключает все виды основных и минорных иммуноглобулинов. Иммуноглобулины имеют вилкообразную структуру, состоящую из двух тяжелых (Н) цепей и двух лёгких цепей (L). Иммуноглобулины, в свою очередь, входят в составсуперсемейства, включающего иммуноглобулины, рецепторы к Т-антигенам, белки гистиосовместимости.
studfiles.net
ФЕРМЕНТЫ.
Количество просмотров публикации ФЕРМЕНТЫ. - 585
КЛАССИФИКАЦИЯ БЕЛКОВ.
1)Основанная на функциях (ферменты, гормоны, транспортные и так далее)
2) Основанная на различиях в форме белковой молекулы:
а) фибриллярные (в виде нити) – к примеру коллаген.
б) глобулярные (сфера, элипс) – к примеру, все ферменты.
3) Основана на составе белков:
а) простые (состоят только из аминокислот )
б) сложные (состоят из органической и неорганической группировки не пептидной природы, которая принято называть простетической группой, соединенных с пептидной цепью).
1) Простые белки (протеины):
1) Альбумины.
2) Глобулины.
3) Протамины
4) Гистоны.
5) Проламины.
6) Глютеллины.
7) Протеиноды.
2)Сложные белки (протеиды):
1) Хромопротеиды:
а) гемопротеиды,
б) флавопротеиды
2) Липопротеиды.
3) Гликопротеиды.
4) Нуклеопротеиды.
5) Фосфопротеиды.
6) Металлопротеиды.
ХАРАКТЕРИСТИКА ОСНОВНЫХ ГРУПП ПРОСТЫХ БЕЛКОВ.
1) Альбумины – молекулярная масса составляет 30000 – 40000 Дальтон. Изоэлектрическая точка равна пяти (Pi), так как содержит в составе много глютаминовой кислоты. Трудно осаждается (осаждаются только насыщенными растворами сульфата аммония). Широко распространены в тканях: плазме крови, печени, мышцах и так далее. Их содержание в плазме достигает 40 – 50 г/л. синтезируется в печени. Будучи высокогидрофильными белками, обеспечивают онкотическое давление крови.,осуществляет тарнспорт многих гормонов, витаминов, билирубина и других веществ. При длительном голодании могут играть роль белкового резерва. Участвует в связывании и последующей инактивации многих эндогенных веществ.
2) глобулины – молекулярная масса достигает нескольких сотен тысяч Дальтон. Изоэлектрическая точка Pi = 7.
Не растворимы в воде, но растворимы в слабых солевых растворах 5 – 10 Na%(K) Cl. Осаждается полунасыщенным раствором сульфата аммония. Их содержание в плазме крови составляет 20 – 30 г/л. Синтезируется в печени и некоторые виды – в лимфоцитах. Входят в состав иммунной системы организма, которая отвечает не только за иммунный ответ организма на внедрение антигенов (чужеродный белок, микроорганизмы и так далее), но и участвуют, в сочетании с другими белками, в белковом ответе на острые воспалительные процессы. Методом электрофареза глобулины сыворотки крови делят на фракции: альфа 1,
альфа 2, бэтта͵ гамма. В клинике часто определяют альбумино-глобулиновый коэффициент (то-есть отношение между альбуминами и глобулинами). В норме данный коэффициент составляет от 1,5 до 2.
3) Протамины – белки с небольшой молекулярной массой (около 5000 Дальтон), то-есть они, в принципе, занимают промежуточное положение между белками и пептидами. Их изоэлектрическая точка лежит в щелочной среде. Потамины обладают основными свойствами, что обусловлено особенностями их аминокислотного состава (в их составе высок процент базовых аминокислот: аргинина (до 80 процентов) и лизина ). Входит в состав простетической группы нуклеопротеидов. Являются антогонистом антикоагулянта гепарина.
4) Гистоны – молекуярная масса 10000 – 20000. Основные свойства у гистонов выражены слабее, чем у протаминов поскольку в состав гистонов входит около 20 – 30 процентов базовых аминокислот (лизина и аргинина). Выделяют пять видов гистонов (Н1, Н2, Н3, Н4, Н5), которые отличаются друг от друга содержанием лизина и аргинина, (в одних больше аргинина -Н1, в других - лизина – Н2). Входят в состав нуклеопротеидов, участвуют в храненинии и передаче генетической информации. Способны влиять на активность различных генов.
5,6) Глютеллины и проламины - ϶ᴛᴏ белки растительного происхождения, много содержится в злаках. В их составе много гидрофобных аминокислотных остатков.
7)Протеиноиды – или, как их называют, белковоподобные вещества, имеют очень бедный аминокислотный состав, очень мало циклических аминокислот, но содержат большое количество гидрофобных аминокислот (аланин, валин, лейцин и другие), к примеру, эластин содержит до 93 процентов таких аминокислот. Протенноиды почти не растворимы в воде и солевых растворах, водно-спиртовых смесях. Трудно расщепляются ферментами желудочно-кишечного тракта. Виды протеноидов: эластин, кератин, коллаген.
а) эластин –белок эластических волокон. Его много содержится в стенках больших кровеносных сосудов, в связках. Основная субъединица фибрилл эластина – тропоэластин имеет молекулярную массу 72000 Дальтон. Волокна эластина построены из относительно небольших, почти сферических молекул, соединенных в волокнистые тяжи с помощью жестких поперечных сшивок. Различают два вида сшивок: десмозин и изодесмозин, обе с участием четырех остатков лизина.
R
|
R__ __R
N +
|
R –
б) Кератин – различают альфа- и бэтта-кератин. Типичный пример бэтта-кератина – фиброин шелка и паутины. Полипетидная цепь у них вытянута вдоль одной оси. Соседние цепи сшиваются водородными связями, они антипараллельны. Альфа-кератины - ϶ᴛᴏ нерастворимые и плотные белки, входящие в состав волос, ногтей, рогов, шерсти и так далее. Полипептидные цепи альфа кератинов уложены в альфа-спирали, стабилизация которых осуществляется за счёт водородных и дисульфидных связей.
в) Коллаген – наиболее изученный из фибриллярных белков, это основной компонент соединительной ткани, главный структурный белок всех животных клеток. Около 60 процентов массы всего белка и 6 процентов общей массы тела приходится на коллаген. Его количество в нашей биосфере оценивают в 1 миллиард тонн. Каждое макроволокно соединительной ткани представляет собой агрегат молекул коллагена. Длинна молекулы коллагена 300 нанометров, молярная масса 300000. Структура молекулы коллагена – перекрученная спираль (ее называют тропоколлаген) - ϶ᴛᴏ три одинаковые левовращающие цепи (содержат примерно 1000 аминокислотлных остатков) скручены вместе с образованием правовращающей тройной спирали. Каждая цепь имеет гораздо более вытянутую структуру, чем альфа-спираль. Структура тройной спирали обусловлены аминокислотным составом и последовательностью аминокислотных остатков в полипептидных цепочках. Почти одну треть аинокислотных остатков составляет глицин, одна четвертая приходится на пролин и гидроксипролин, остальное – небольшое количество остальных аминокислот, включая гидроксилизин. Перекрученнная структура тройной спирали стабилизирована многочисленными межмолекулярными водородными , дисульфидными и другими связями. Важную роль играют ковалентные связи между цепями, содержащими лизин и гидроксилизин. Таким образом структура обладает жесткостью и почностью (нить коллагна толщиной один мм спосбна выдержать нагрузку сто ньютон (10 кг)). По мере старения организма, число поперечных связей увеличивается, что делает фибриллы коллагена более жесткими и хрупкими, а это приводит к изменению механических свойств хрящей и суставов, делает более ломкими кости, понижает прозрачность роговицы глаза. При кипячении в воде коллаген превращается в желатину – растворимую смесь пептидов.
ХАРАКТЕРИСТИКА ОСНОВНЫХ ГРУПП СЛОЖНЫХ БЕЛКОВ.
1) Хромопротеиды – состоят из простого белка, соединенного с окрашенной простетической группой (отсюда и название: chroma - краска). Подразделяются на:
а) гемопротеиды – в качестве простетической группы – гем. К этим белкам относятся: гемоглобин, миоглобин, ряд ферментов (каталаза, пероксидаза, цитохромы). Функции многообразны: участвуют в транспорте газов, окислительно-восстановительных реакциях и так далее.
б) флаворотеиды – простетическую группу составляют ФАД и ФМН (производные изоаллоксазина). Это некоторые фермнты (флавиновые дегидрогеназы), катализирующие окислительно-восстановительные реакции.
2) Липопротеиды – состоят из простого белка, связанного с каким-либо липидом, представляющим простетическую группу. Это должна быть нейтральный жир, свободная жирная кислота͵ фосфолипиды, холестерин. Липопротеиды входят в состав биомембран, миелиновых оболочек, присутствуют в свободном состоянии в плазме крови.
3) Гликопротеины – их простетическая группа представлена углеводами и их производными (глюкоза,галактоза, манноза,галактозамин, сиаловые кислоты, гликозаминогликаны). Гликопротеиды входя в состав слюны, хрящевой, костной ткани,биомембран, участвуют в иммунологических реакциях, ионном обмене и так далее.
4) Нуклеопротеиды – состоят из белков (которые, в основном, представлены протаминами и гистонами) и нуклеиновых кислот (простетическая группа). Их основная функция – хранение и передача наследственной информации.
5) Фосфопротеиды – в качестве простетической группы выступает фосфорная кислота. Большое количество этих белков содержится в ткани мозга. К фосфопротеидам относят казеин молока. Функции фосфопротеидов многообразны. Οʜᴎ являются донорами фосфатов в клетке, являются источниками пластического и энергетического материала.
6) Металлопротеиды – простетическая группа представлена металлами (цинк, железо, медь, кобальт и другие). К этой группе белков относятся ферритин (выполняет роль депо железа, содержится в печени, селезенке, костном мозге ), трансферрин (переносчик железа), некоторые ферменты (алкогольдегидрогеназа, карбангидраза, СОД и другие).
Еще в 1878 году Куне с целью унификации терминологии предложил называть каталитически активные соединения энзимами. В последние пятьдесят лет данный термин стал общепризнанным в литературе на всех языках. В переводе с греческого данный термин означает: ʼʼиз дрожжейʼʼ. В литературе на русском принят термин ʼʼферментыʼʼ (fermentatio (с латинского) - сбраживание), хотя изучение ферментов и процессов с их участием традиционно называют ʼʼэнзимологияʼʼ .
По завершении девятилетних исследований в 1926 году Самнер сообщил о выделении из бобов фермента уреаза, и предположил, что она имеет белковую природу, что сочли поначалу нелепым. Последующие исследования Самнера и независимо Нортропа и Стэнли привели к выделению еще нескольких ферментов (к примеру, в 1930 – 31 году Нортроп получил в чистом виде пепсин и трипсин).
Катализаторы - ϶ᴛᴏ вещества, ускоряющие химические реакции. Ферменты являются белковыми катализаторами биохимических реакций. В отличие от небелковых катализаторов, каждый фермент способен катализировать лишь очень небольшое число реакций, часто только одну. Таким образом ферменты являются специфическими катализаторами. Практически все биохимические реакции катализируются ферментами.
В 1814 году Киркгофф выделил амилазу из семян проросшего ячменя, которая сбраживала крахмал. В то время господствовало виталистичесое деление ферментов на ʼʼорганизованныеʼʼ и ʼʼнеорганизованныеʼʼ. В конце 19 века М. М. Манасеина, А. И. Лебедев (Россия) и братья Бюхнер (Германия) показали, что так делить ферменты нельзя. В начале двадцатого века И. П. Павлов предположил белковую природу ферментов.
И, наконец, в 1935 году белковая природа ферментов стала общепризнанной, Это имело большое значение (достаточно сказать, что за эти открытия в 1946 году Самнеру, Нортропу и Стенли была присуждена Нобелевская премия). За последние пятьдесят лет было выделено из всех типов организмов около 2500 ферментов, часть из них получена в кристаллическом виде, для более пятидесяти ферментов открыта третичная структура. В клетках кишечной палочки содержится около тысячи различных ферментов, а у человека еще больше.
Функции ферментов сводится к ускорению химических реакций, причем ферменты отличаются тремя уникальными свойствами:
1 )Это самые эффективные из всех известных катализаторов, так что даже очень малые (микромолярные) концентрации ферментов способны в очень большой степени ускорять реакции (в миллион и более раз, чем если бы реакция протекла бы без фермента). В самом деле в отсутствие ферментов скорость большинства реакций в биологических системах практически неощутима. Такая простая реакция, как гидратирование углекислого газа. В отсутствие фермента перенос углекислого газа из тканей кровь и затем в воздух легочных альвеол был бы не полон. Карбангидраза, катализирующая данный процесс является одним из самых активных ферментов. Каждая ее молекула способна гидратировать десять в пятой степени молекул углекислого газа в секунду. При этом скорость реакции в присутствии фермента в десять в седьмой степени раз выше, чем в его отсутствие.
2) Большинство ферментов отличаются специфичностью действия (практически каждая реакция катализируется специальным ферментом). Специфичность проявляется как в отношении катализируемой реакции, так в и отношении субстратов.
Каждый фермент катализирует какую-либо одну химическую реакцию или несколько очень сходных реакций. Степень специфичности к субстрату очень высока, а иногда практически абсолютна. Рассмотрим в качестве примера протеолитическте ферменты. Οʜᴎ катализируют реакцию гидролиза пептидной связи; многие протеолитические ферменты катализируют еще и иную, но сходную реакцию гидролиза эфирной связи. Протеолитические ферменты сильно различаются по степени субстратной специфичности. К примеру, субтилизин (он синтезируется определенным видом бактерий) расщепляет практически любые пептидные связи в независимости от того, какими аминокислотами они образованы. Трипсин расщепляет пептидные связи, образованные только карбонильными группами лизина и аргинина. Тромбин (участвующий в свертывание крови) разрывает только те петидные связи, котрые образованы карбонильной группой аргинина и аминогруппой глицина.
3) Действия большинства ферментов регулируется (то-есть они способны переходить из состояния с низкой активностью к состоянию с высокой активностью и обратно). В совокупности эти механизмы регуляции представляют сложную систему, посредством которой организм контролирует все свои функции. Некоторые ферменты синтезируются в форме неактивного предшественника и переходят в активное состояние в физиологически соответствующем месте и времени. Примером регуляции такого типа могут служить пищеварительные ферменты. Так, к примеру, пепсиноген синтезируется в поджелудочной железе, а активируется в тонком кишечнике, где в результате расщепления пептидной связи образуется активная форма – трипсин. Такой же тип регуляции многократно используется в последовательности ферментативных реакций, ведущих к свертыванию крови. Каталитически неактивные предшественники протеолитических ферментов называются проферментами или зимогенами. С помощью ферментов осуществляется трансформация различных видов энергии. Во многих биохимических реакциях энергия реагирующих веществ переходит из одной формы в другую с высокой степенью эффективности. К примеру, при фотосинтезе энергия света переходит в энергию химических связей. В митохондриях свободная энергия, содержащаяся в низкомолекулярных веществах поступающих с пищей переходит в энергию АТФ, которая затем может использоваться во многих процессах – при мышечном сокращении, при трансмембранном транспорте и так далее. Ферменты не сдвигают равновесие химических реакций, они лишь ускоряют наступление этого равновесия. Отсутствие даже одного фермента или его дефект могут иметь очень серьезные отрицательные последствия для организма. Впервые фермент синтезировал в 1966 году (рибонуклеазу) Меррифилд. Поскольку ферменты – белки, они бывают мономерными (одна полипептидная цепь) - ϶ᴛᴏ пепсин, трипсин, уреаза и так далее; или олигомерными (к примеру, ЛДГ). Олигомеры в определенных условиях могут дисссоциировать на мономеры. Биологическая активность олигомерных ферментов проявляется либо в диссоциированном, либо в не диссоцированном состоянии. Все ферменты относятся к глобулярным белкам. Соответствнно ферменты бывают простые (рибонуклеаза) и сложные (каталазы). Максимальная активность сложных белков (ферментов) зависит от участия небелковых соединений, называемых ко-факторами. Молекулярный комплекс белка и ко-фактора принято называть холоферментом и обладает максимальной каталитической активностью. Белковый компонент, лишенный ко-фактора принято называть апоферментом, он обладает очень низкой активностью, а часто вообще не активен. Некоторые ферменты требуют два или три различных ко-фактора и обычно один из них неорганический ион. Связь между белковым компонентом (апоферментом) и ко-фактором должна быть ковалентной или нековалентной. Внекоторых случаях ко-фактор и фермент существуют отдельно и связываются друг с другом только на время протекания реакции. В других случаях ко-фактор и фермент связаны постоянно, иногда очень прочно, ковалентными связями. Вообще говоря, роль ко-фактора сводится:
1) к изменению трехмерной структуры белка и (или) связанного субстрата для улучшения условий взаимодействия фермента с субстратом;
2) к непосредственному участию в реакции в качестве еще одного субстрата.
Различают неорганические ко-факторы (к примеру, ионы цинка, магния, марганца, железа, меди, калия и натрия) и органические (их обычно называют ко-ферменты - ϶ᴛᴏ около десятка соединений различной структуры). Как правило, связь между ко-фактором неорганической природы и апоферментом прочная и, в случае если ее разорвать, то ни ко-фактор, ни белковая часть фермента не проявляют активности. Большая часть ко-ферментов либо образуется из витаминов, либо представляют из себявитамины, либо витамины являются частью ко-фермента. По этой причине, неорганические ионы, перечисленные выше, и витамины должны обязательно входить в рацион для любого организма. В качестве примера витаминов, входящих в неизменном виде в состав фермента͵ можно привести биотин, липоевую кислоту и так далее. Так, биотин связывает углекислоый газ, а липоевая кислота переносит ацильную групу. Такие же витамины, как рибофлавин (витамин В2) превращаются в ФАД или ФМН, то-есть в качестве ко-фермента выступают их производные, которые участвуют в окислительно-востановительных реакциях. Органические ко-ферменты обычно выступают в качестве дополнительных субстратов. Участие ко-ферментов в процессе обычно сводится к донорным или акцепторным функциям (по отношению к другим субстратам или субстрату) определенной химической группировки. Может происходить, к примеру, перенос метильной группы – СН3, аминогруппы – Nh3, электролитов. В соответстви с этим ко-фермент называют ʼʼпереносчиком группʼʼ. К примеру, в присутствии передоксальфосфатзависимого фермента перенос аминогруппы осуществляется за одну реакцию, а для другого случая – электрон вместе с протоном – в результате двух реакций, катализируемых разными ферментами, но с участием одного ко-фермента (НАД):
НАД + НАДН НАД+
ко-фермент участвует в обеих реакциях, причем в одной НАД - ϶ᴛᴏ продукт, а в другой – реагент. Такие реакции называются сопряженными.
Мы уже упоминали, что ферменты бывают мономерные и олигомерные. В свою очередь, олигомерные могут иметь в своем составе одинаковые субъединицы (к примеру, каталаза имеет 6 субъединиц и все одинаковые) или разные, что предопределяет возникновение изомерных форм ферментов (к примеру, ЛДГ – тетрамер, но имеет два типа субъединиц). Чем больше разных субъединиц входит в состав фермента͵ тем больше появляется его изомерных форм. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, мы можем сказать, что изоферменты - ϶ᴛᴏ ферменты, катализирующие одну и ту же реакцию, но отличающиеся по каталитической активности., физико-химическим свойством и составу. К примеру, ЛДГ имеет два вида субъединиц: Н (hart) и М (muscle). Соответственно образуется пять различных изоферментов (тетрамеров). Варианты: НННН, НННМ, ННММ, НМММ, ММММ, или их называют, соответствнно ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5. Соотношение изоферментных фракций в разных органах различно (к примеру, в сердце преобладает ЛДГ1, в мышцах и в печени ЛДГ5). Изучая изоферментный спектр, можно судить о локализации патологическго процесса и о степени тяжести. Биологическое значение изоферментов состоит по сути в том, что они обеспечивают протекание химических реакций в различных тканях, исходя из условий обмена в данной ткани. К примеру ЛДГ1 и ЛДГ2 наиболее активны в тканях с высокой скоростью окисления и высоким содержанием кислорода. Эти изоферменты обладают высоким сродством к кислороду и наиболее активны в эритроцитах и миокарде. ЛДГ5 наиболее активна в тканях с меньшим содержанием кислорода, к примеру в печени и скелетных мышцах – где высокая концентрация молочной кислоты. С возрастом происходит изменение активности изоферментов в тканях (у детей).
Изоферментные формы характерны для тех ферментов которые в тканях выполняют особо важные функции то-есть стоят на перекрестке особо важных каталитических процессов (к примеру ЛДГ – на границе аэробного и анаэробного процессов).
НОМЕНКЛАТУРА ФЕРМЕНТОВ.
1)Тривиальная, исторически сложившаяся (пепсин – от pepsis – пищеварение; трипсин – от tripsis - расжижение). Цитохромы (cytos – клетка, chromos - цвет) – окрашивающие клетку.
2) Рабочая: а) название субстрата плюс окончание ʼʼазаʼʼ. К примеру , сахараза, мальтаза, липаза. Иногда берется греческое или латинское название, к примеру amylos (крахмал) – фермент принято называть амилаза.
б) По названию типа катализируемой реакции (гидролаза, синтетаза, дегидрогеназа, и так далее).
в) По типу расщепляемой связи (пептидаза, эстераза, гликозидаза и так далее).
3) Систематическая (международная): крайне важно дать точное название субстрата (химическое название), указать характар процесса и прибавить окончание ʼʼ-азаʼʼ. К примеру, попросту уреаза, а по международной номенклатуре: карбамидамидогидролаза (то-есть карбамид-мочевина и разрыв-гидролиз амидной связи). В случае если в реакции участвует ко-фермент, то это тоже должно быть отражено в названии. К примеру, попросту ЛДГ, а по международной номенклатуре – альфа-лактат-НАД-оксидоредуктаза.
referatwork.ru
Что такое протеины и протеиды? Каково пищевое значение белков?
Протеин (от англ. - protein – белок) – добавка, состоящая на 70 – 95 % из белка - самого важного строительного материала для питания и наращивания мускулатуры. В зависимости от натуральных источников происхождения белков в продукте, в спортивном питании выделяют сывороточный протеин, молочный (казеиновый) протеин, яичный протеин, соевый протеин, а также гидролизат молочной сыворотки. Существуют также протеиновые изоляты (изолированные протеины) – протеины с наиболее высоким содержанием белка Протеиды, сложные белки; состоят из простого белка — протеина и компонента небелковой природы, называется простетической группой. В зависимости от характера простетической группы П. подразделяют на гликопротеиды, липопротеиды, нуклеопротеиды, хромопротеиды, фосфопротеиды. К П. относятся многие белки-ферменты. Простетическая группа присоединена к молекуле простого белка ковалентными или нековалентными связями; отрыв простетической группы приводит к снижению устойчивости (лабилизации) белкового компонента, иногда к его денатурации. П. играют важную роль в жизнедеятельности организма: они участвуют во многих узловых реакциях процесса обмена веществ и энергии, являются структурными компонентами клеток и тканей. Белок является важнейшим компонентом пищевых продуктов. В химическом отношении белки представляют собой сложные азотосодержащие биополимеры, мономерами которых являются аминокислоты. Именно содержанием азота белки отличаются от других органических веществ. Белки — высокомолекулярные соединения. Аминокислотный состав разных белков неодинаков и является важной характеристикой каждого белка и критерием его ценности в питании. Каждая аминокислота имеет строго определенное значение при синтезе тканевых белков. Белки делятся на простые и сложные. Простые белки содержат только аминокислоты, или белковую часть. Сложные белки, помимо аминокислот, содержат небелковую часть, или простетическую группу. В зависимости от пространственной структуры белки делят на глобулярные (их молекулы имеют сферическую форму) и фибриллярные (их молекулы имеют нитевидную форму) . К простым глобулярным белкам относят альбумины и глобулины, которые широко распространены в природе и входят в состав молока, сыворотки крови, яичного белка. Многие структурные белки являются фибриллярными белками животного происхождения и выполняют в организме опорную функцию. К ним относятся кератины (белки волос, ногтей, эпидермиса) , эластин (белок связок, соединительной ткани сосудов и мышц) , коллаген (белок костной, хрящевой, рыхлой и плотной соединительной тканей) . По содержанию тех или иных аминокислот белки делятся на биологически полноценные и неполноценные. Биологически полноценные белки содержат незаменимые аминокислоты, т. е. те, которые не синтезируются в организме и попадают в него только с пищей. К ним относятся триптофан, лейцин, изолейцин, валин, метионин, треонин, лизин, фенилаланин, гистидин и аргинин. Неполноценные белки не содержат незаменимых аминокислот.
<a href="/" rel="nofollow" title="49716592:##:" target="_blank" >[ссылка заблокирована по решению администрации проекта]</a> .com/264zo2p неужели это и правда так сложно?
touch.otvet.mail.ru












