2.2.1.2. Структура глобулярных белков. Глобулярным белком является
структура, строение, свойства. Примеры глобулярных и фибриллярных белков
Большое количество органических веществ, входящих в состав живой клетки, отличаются крупными размерами молекул и представляют собой биополимеры. К ним относятся и белки, составляющие от 50 до 80% от сухой массы всей клетки. Мономерами белков являются аминокислоты, связывающиеся между собой с помощью пептидных связей. Белковые макромолекулы имеют несколько уровней организации и выполняют в клетке целый ряд важнейших функций: строительную, защитную, каталитическую, двигательную и др. В нашей статье мы рассмотрим особенности строения пептидов, а также приведем примеры глобулярных и фибриллярных белков, входящих в состав организма человека.
Формы организации макромолекул полипептидов
Аминокислотные остатки последовательно соединяются между собой прочными ковалентными связями, называемыми пептидными. Они достаточно прочные и удерживают в стабильном состоянии первичную структуру белка, имеющую вид цепи. Вторичная форма возникает в момент закручивания полипептидной цепи в альфа-спираль. Она стабилизирована дополнительно возникающими водородными связями. Третичная, или нативная, конфигурация имеет принципиальное значение, так как большинство глобулярных белков в живой клетке имеют именно такое строение. Спираль упаковывается в виде шара или глобулы. Ее устойчивость обусловлена не только появлением новых водородных связей, но и формированием дисульфидных мостиков. Они возникают вследствие взаимодействия атомов серы, входящих в состав аминокислоты цистеина. Не последнюю роль в образовании третичной структуры играют гидрофильные и гидрофобные взаимодействия между группами атомов внутри пептидной структуры. Если глобулярный белок объединяется с такими же молекулами посредством небелкового компонента, например, иона металла, то возникает четвертичная конфигурация – высшая форма организации полипептида.
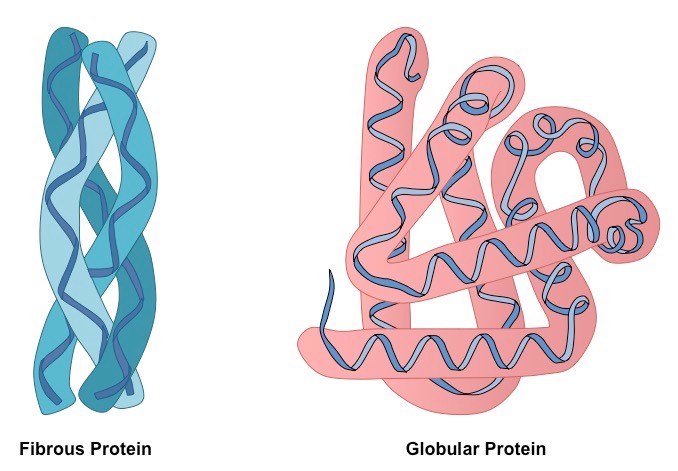
Фибриллярные белки
Сократительную, двигательную и строительную функции в клетке выполняют белки, макромолекулы которых имеют вид тонких нитей – фибрилл. Полипептиды, входящие в состав волокон кожи, волос, ногтей, относят к фибриллярным видам. Наиболее известные из них - это коллаген, кератин и эластин. Они не растворяются в воде, но могут набухать в ней, образуя клейкую и вязкую массу. Пептиды линейного строения входят также в состав нитей веретена деления, образуя митотический аппарат клетки. Они прикрепляются к хромосомам, сокращаются и растягивают их к полюсам клетки. Этот процесс наблюдается в анафазу митоза – деления соматических клеток тела, а также в редукционной и эквационной стадии деления половых клеток – мейозе. В отличие от глобулярного белка фибриллы способны быстро растягиваться и сокращаться. Реснички инфузории-туфельки, жгутики эвглены зеленой или одноклеточной водоросли – хламидомонады построены из фибрилл и выполняют функции движения у простейших организмов. Сокращение мышечных белков – актина и миозина, входящих в состав мышечной ткани, обусловливают разнообразные движения скелетных мышц и поддержание мышечного каркаса человеческого тела.
Структура глобулярных белков
Пептиды – переносчики молекул различных веществ, защитные белки – иммуноглобулины, гормоны – это неполный перечень протеинов, третичная структура которых имеет вид шара – глобулы. В крови присутствуют определенные белки, которые имеют на своей поверхности определенные участки – активные центры. С их помощью они распознают и присоединяют к себе молекулы биологически активных веществ, вырабатываемых железами смешанной и внутренней секреции. С помощью глобулярных белков гормоны щитовидной и половых желез, надпочечников, тимуса, гипофиза доставляются к определенным клеткам организма человека, снабженным специальными рецепторами для их распознавания.
Мембранные полипептиды
Жидкостно-мозаичная модель строения клеточных мембран наилучшим образом приспособлена к выполнению ими важных функций: барьерной, рецепторной и транспортной. Белки, входящие в нее, осуществляют транспорт ионов и частиц некоторых веществ, например глюкозы, аминокислот и др. Изучить свойства глобулярных белков-переносчиков можно на примере натрий-калиевого насоса. Он осуществляет переход ионов из клетки в межклеточное пространство и обратно. Ионы натрия постоянно движутся в середину клеточной цитоплазмы, а катионы калия - из клетки наружу. Нарушение нужной концентрации этих ионов приводит к гибели клетки. Чтобы предотвратить эту угрозу, в клеточную мембрану встроен специальный протеин. Строение глобулярных белков таково, что они переносят катионы Na+ и K+ против градиента концентрации с использованием энергии аденозинтрифосфорной кислоты.
Строение и функции инсулина
Растворимые белки шаровидной структуры, находящиеся в третичной форме, выполняют функции регуляторов обмена веществ в организме человека. Вырабатываемый бета-клетками островков Лангерганса инсулин осуществляет контроль уровня глюкозы в крови. Он состоит из двух полипептидных цепей (α- и β- формы), соединенных несколькими дисульфидными мостиками. Это ковалентные связи, возникающие между молекулами серосодержащей аминокислоты – цистеина. Гормон поджелудочной железы в основном состоит из упорядоченной последовательности аминокислотных звеньев, организованных в форме альфа-спирали. Незначительная его часть имеет вид β- структуры и аминокислотных остатков без строгой ориентации в пространстве.
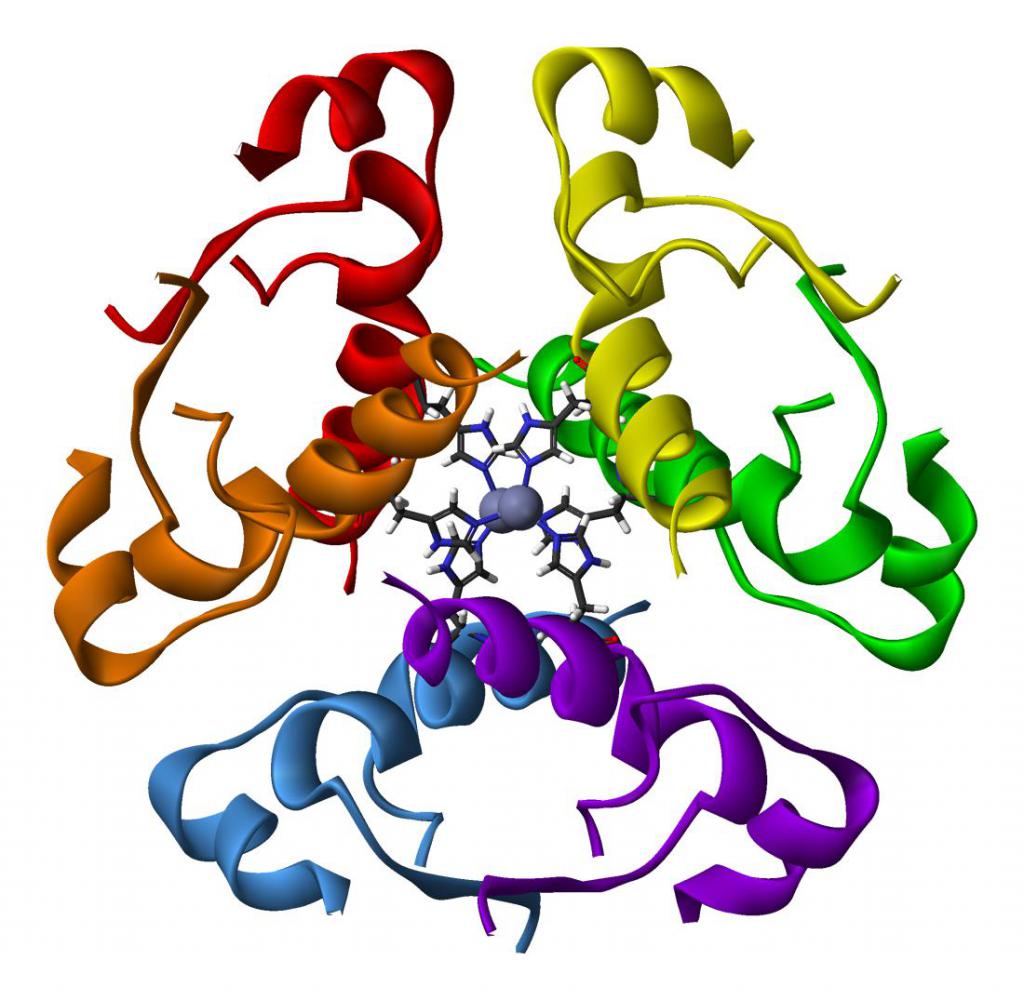
Гемоглобин
Классическим примером глобулярных пептидов служит белок крови, обусловливающий красную окраску крови – гемоглобин. Протеин содержит четыре полипептидных участка в виде альфа- и бета-спирали, которые связаны небелковым компонентом - гемом. Он представлен ионом железа, связывающим полипептидные цепи в одну конфирмацию, относящуюся к четвертичной форме. К молекуле протеида присоединяются частицы кислорода (в таком виде он называется оксигемоглобином) и далее транспортируются к клеткам. Это обеспечивает нормальное протекание процессов диссимиляции, так как для получения энергии клетка окисляет поступившие в нее органические вещества.
Роль белка крови в транспорте газов
Кроме кислорода гемоглобин способен также присоединять углекислый газ. Диоксид углерода образуется как побочный продукт катаболических клеточных реакций и подлежит удалению из клеток. Если во вдыхаемом воздухе присутствует монооксид карбона – угарный газ, он способен образовывать прочное соединение с гемоглобином. В этом случае токсическое вещество без цвета и запаха в процессе дыхания быстро проникает к клеткам организма, вызывая отравление. Особенно чувствительны к высокой концентрации угарного газа структуры головного мозга. Возникает паралич дыхательного центра, расположенного в продолговатом мозге, что влечет за собой смерть от удушья.
В нашей статье мы рассмотрели структуру, строение и свойства пептидов, а также привели примеры глобулярных белков, выполняющих в организме человека ряд важных функций.
fb.ru
Глобулярные белки на Medside.ru
Читайте нас и будьте здоровы! Условия использования о портале обратная связь- Врачи
- Болезни
- Кишечные инфекции (4)
- Инфекционные и паразитарные болезни (20)
- Инфекции, передающиеся половым путем (6)
- Вирусные инфекции ЦНС (2)
- Вирусные поражения кожи (5)
- Микозы (9)
- Гельминтозы (3)
- Злокачественные новообразования (8)
- Доброкачественные новообразования (4)
- Болезни крови и кроветворных органов (3)
- Болезни щитовидной железы (5)
- Болезни эндокринной системы (12)
- Недостаточности питания (1)
- Психические расстройства (25)
- Воспалительные болезни ЦНС (2)
- Болезни нервной системы (17)
- Двигательные нарушения (4)
- Болезни глаза (15)
- Болезни уха (3)
- Болезни системы кровообращения (8)
- Болезни сердца (4)
- Болезни артерий, артериол и капилляров (7)
- Болезни вен, сосудов и лимф. узлов (6)
- Болезни органов дыхания (17)
- Болезни полости рта и челюстей (13)
- Болезни органов пищеварения (25)
- Болезни печени (1)
- Болезни желчного пузыря (5)
- Болезни кожи (27)
- Болезни костно-мышечной системы (29)
- Болезни мочеполовой системы (10)
- Болезни мужских половых органов (8)
- Болезни молочной железы (3)
- Болезни женских половых органов (26)
- Беременность и роды (5)
- Болезни плода и новорожденного (3)
- Врожденные аномалии (пороки развития) (10)
- Травмы и отравления (8)
- Симптомы
- Амнезия (потеря памяти)
- Анальный зуд
- Апатия
- Афазия
- Афония
- Ацетон в моче
- Бели (выделения из влагалища)
- Белый налет на языке
- Боль в глазах
- Боль в колене
- Боль в левом подреберье
- Боль в области копчика
- Боль при половом акте
- Вздутие живота
- Волдыри
- Воспаленные гланды
- Выделения из молочных желез
- Выделения с запахом рыбы
- Вялость
- Галлюцинации
- Гнойники на коже (Пустула)
- Головокружение
- Горечь во рту
- Депигментация кожи
- Дизартрия
- Диспепсия (Несварение)
- Дисплазия
- Дисфагия (Нарушение глотания)
- Дисфония
- Дисфория
- Жажда
- Жар
- Желтая кожа
- Желтые выделения у женщин
- ...
- ПОЛНЫЙ СПИСОК СИМПТОМОВ>
- Лекарства
- Антибиотики (211)
- Антисептики (122)
- Биологически активные добавки (210)
- Витамины (192)
- Гинекологические (183)
- Гормональные (156)
- Дерматологические (258)
- Диабетические (46)
- Для глаз (124)
- Для крови (77)
- Для нервной системы (385)
- Для печени (69)
- Для повышения потенции (24)
- Для полости рта (68)
- Для похудения (40)
- Для суставов (161)
- Для ушей (14)
- Другие (308)
- Желудочно-кишечные (314)
- Кардиологические (149)
- Контрацептивы (48)
- Мочегонные (32)
- Обезболивающие (280)
- От аллергии (102)
- От кашля (137)
- От насморка (91)
- Повышение иммунитета (123)
- Противовирусные (114)
- Противогрибковые (126)
- Противомикробные (144)
- Противоопухолевые (65)
- Противопаразитарные (49)
- Противопростудные (90)
- Сердечно-сосудистые (351)
- Урологические (89)
- ДЕЙСТВУЮЩИЕ ВЕЩЕСТВА
- Справочник
- Аллергология (4)
- Анализы и диагностика (6)
- Беременность (25)
- Витамины (15)
- Вредные привычки (4)
- Геронтология (Старение) (4)
- Дерматология (3)
- Дети (15)
- Другие статьи (22)
- Женское здоровье (4)
- Инфекция (1)
- Контрацепция (11)
- Косметология (23)
- Народная медицина (17)
- Обзоры заболеваний (27)
- Обзоры лекарств (34)
- Ортопедия и травматология (4)
- Питание (37)
- Пластическая хирургия (8)
- Процедуры и операции (23)
- Психология (10)
- Роды и послеродовый период (35)
- Сексология (9)
- Стоматология (9)
- Травы и продукты (13)
- Трихология (7)
- Словарь терминов
- [А] Абазия .. Ацидоз (114)
- [Б]
medside.ru
Глобулярный белок: строение. Примеры глобулярных белков
Для возникновения простейшей биологической системы в условиях нашей планеты достаточно присутствия всего двух видов органических веществ: нуклеиновых кислот и белков. Структура этих соединений имеет как черты сходства, так и кардинальные различия. Например, они являются биополимерами, находятся во всех без исключения клетках живых организмов. Соединения под действием негативных факторов могут изменять свою нативную структуру - подвергаться денатурации и деструкции. В нашей статье мы рассмотрим, какую роль выполняют белки в молекулах сложных веществ, например, таких как гликопротеиды и липопротеиды. Также изучим особенности строения глобулярных белков и приведем примеры различных их видов.
Строение пептидов
Гигантские размеры белков (по сравнению с величиной других клеточных органических соединений - углеводов, жиров, витаминов и т. д.) объясняются их строением. Все белки, иначе называемые протеинами, представляют собой сложные комплексы – полимеры. Они имеют не только большую молекулярную массу, но и несколько форм пространственного расположения собственной макромолекулы. Элементарные частицы белкового полимера – это 20 видов аминокислот, участвующих в реакции поликонденсации. Они соединяются между собой посредством пептидных связей -CO—NH-, благодаря которым и образуется простейшая форма макромолекулы. Такая структура белков носит название первичной или линейной конфигурации. Образование дополнительных, сначала водородных связей, а затем и дисульфидных мостиков приводит к появлению спиральной и глобулярной форм белка. Третичная конфигурация в форме сферических молекул – глобул– распространена в живых биосистемах: клетках, органах, тканях. Она может усложняться в виде нескольких глобул, связанных небелковым компонентом, и образовывать высшую форму организации – четвертичную структуру.

Гемоглобин
В систему жидких сред организма входит кровь. Ее главная функция – это транспорт различных соединений. Кроме питательных веществ, например глюкозы, содержащейся в кровяной плазме, к клеткам поступает кислород, а удаляется из них углекислый газ. Молекулы O2 соединяются со специальным белком – гемоглобином – и далее, в связанном состоянии, разносятся к клеткам. Кислород необходим им для процесса дыхания, которое заключается в окислении органических веществ. Гемоглобин представляет собой глобулярный белок, который состоит из четырех аминокислотных цепей. Они удерживаются вместе благодаря небелковому компоненту, который называется гемом и содержит ион железа. Комплекс кислорода и протеина называется оксигемоглобином. В процессах метаболизма в клетках образуется побочный продукт распада – углекислый газ. Его молекулы также способны соединяться с гемоглобином, образуя карбоксигемоглобин. Углекислый газ поступает в органы дыхания и путем диффузии, затем удаляется из организма во время выдоха.

Свойства глобулярных белков
В основе гуморального вида иммунитета лежит способность специфических белков к выполнению функции защиты клеток, органов и тканей от повреждающего действия патогенной микрофлоры и микрофауны: вирусов, бактерий, простейших, грибков и т. д. Глобулярные белки-антитела взаимодействуют как с самими возбудителями, так и с их токсинами по принципу "ключ – замок". Антитела включаются в обмен веществ бактерии или вируса и блокируют его. Чем выше сродство защитных протеинов и их специфичность, тем быстрее антитела уничтожают патогенные факторы. Человечество успешно борется с такими тяжелыми заболеваниями, как столбняк, корь или дифтерия, вводя здоровым людям, побывавшим в контакте с заболевшими, уже готовые антитела в виде сывороток. Эти вещества получают из крови предварительно зараженных животных: свиней, коров или обезьян, содержащей антитела. Сыворотка имеет в своем составе необходимый защитный глобулярный белок и помогает предотвратить заражение или облегчить протекание уже начавшейся болезни.

Ферменты
Химические реакции в клетках, в отличие от аналогично проведенных в лаборатории или происходящих в природе, протекают очень быстро. Объясняется это участием в них особых веществ – энзимов или ферментов. Биологический активатор скорости определенной реакции процесса обмена веществ – это глобулярный белок, имеющий сложное строение. В его составе есть специфическое образование – активный центр, связывающийся с субстратом реакции. Он и влияет на скорость процесса, происходящего с веществом. Все ферменты специфичны и влияют только на определенный химический процесс.

Классификация
Протеины, имеющие шаровидную форму молекулы и влияющие на протекание реакций ассимиляции и диссимиляции, можно разделить на несколько видов. Критериями будут типы реакции, форма и локализация фермента в клетке. К глобулярным белкам относится класс ферментов: пепсин, амилаза, глутаминсинтетаза, синтаза жирных кислот и т. д. Приведем несколько примеров.
Виды и функции глобулярных протеинов
Пепсин осуществляет расщепление пищевых белков в желудке в процессе энергетического обмена. Он синтезируется слизистым слоем желудочных клеток, состоящим из железистого эпителия. Амилаза, в отличие от пепсина, содержится не только в организме человека или животных, но и у растений. У них фермент образуется в момент прорастания семени, синтезируясь в летках зародыша. Он и ускоряет расщепление крахмала до глюкозы, необходимой для прорастания семени. У млекопитающих амилаза входит в состав панкреатического сока и расщепляет сложные углеводы. Синтаза жирных кислот – это крупный фермент цитоплазмы, обеспечивающий синтез жиров и высших жирных кислот.

В нашей статье мы изучили строение и свойства глобулярных белков.
www.nastroy.net
ГЛОБУЛЯРНЫЕ БЕЛКИ - это... Что такое ГЛОБУЛЯРНЫЕ БЕЛКИ?
ГЛОБУЛЯРНЫЕ БЕЛКИ ГЛОБУЛЯРНЫЕ БЕЛКИбелки, полипептидные цепи к-рых свёрнуты в компактные сферические или эллипсоидные структуры (глобулы). Важнейшие представители Г. б.— альбумины, глобулины, протамины, гистоны, проламины, глутелины. В отличие от фибриллярных белков, играющих гл. обр. опорную или защитную роль в организме, мн. Г. б. выполняют динамич. функции. К Г. б. относятся почти все известные ферменты, антитела, нек-рые гормоны и мн. транспортные белки. Характеристикой формы Г. б. является отношение большой и малой осей эллипсоида, значение к-рого широко варьирует в зависимости от типа белка (напр., для яичного альбумина это соотношение близко к 3, а для зеина кукурузы — к 20). Большинство полярных боковых групп аминокислотных остатков полипептидных цепей Г. б. находится на поверхности глобул в гидратир. состоянии, а гидрофобные группы скрыты внутри глобул, поэтому Г. б. растворимы в полярных растворителях.
.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
.
- ГЛОБУЛИНЫ
- ГЛИГЕРА ПРАВИЛО
Смотреть что такое "ГЛОБУЛЯРНЫЕ БЕЛКИ" в других словарях:
ГЛОБУЛЯРНЫЕ БЕЛКИ — белки, в молекулах которых полипептидные цепи плотно свернуты в компактные шарообразные структуры глобулы. К глобулярным белкам относятся ферменты, антитела, некоторые гормоны и многие другие белки, выполняющие в клетках динамические функции. Ср … Большой Энциклопедический словарь
глобулярные белки — – белки, имеющие цилиндрическую или сферическую форму, хорошо растворимы в воде … Краткий словарь биохимических терминов
глобулярные белки — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры глобулы. К глобулярным белкам относятся ферменты, антитела, некоторые гормоны и многие другие биологически активные белки. Ср. Фибриллярные белки.… … Энциклопедический словарь
Глобулярные белки — Трехмерная структура молекулы гемоглобина глобулярного белка Глобулярные белки белки, в молекулах которых полипептидные цепи плотно свёрнуты в ком … Википедия
ГЛОБУЛЯРНЫЕ БЕЛКИ — белки, в молекулах к рых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры глобулы. К Г. б. относятся ферменты, антитела, нек рые гормоны и мн. др. биологически активные белки. Ср. Фибриллярные белки … Естествознание. Энциклопедический словарь
Глобулярные белки — (от лат. globulus шарик) кристаллические хорошо растворимые в воде или слабых растворах солей Белки; форма молекул у них близка к шарообразной (отношение осей сферы не превышает 5). Такое строение молекул обеспечивается спирализацией… … Большая советская энциклопедия
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
dic.academic.ru
2.2.1.2. Структура глобулярных белков
Кроме структурных функций белки выполняют ещё ряд разнообразных функций. Среди них одна из главных - катализ химических реакций, протекающих в клетке.
1) Для осуществления каталитической (ферментативной) функции белок должен связываться с трехмерным субстратом, т.е. место связывания в молекуле белка, называемое активным центром, должно быть трехмерным. Это возможно только при условии, что сам белок имеет трехмерную третичную (глобулярную) структуру.
Таким образом, соответствие структуры и функции, предопределяет наличие у функциональных белков глобулярной структуры.
2) Кроме того, глобулярная структура обеспечивает растворимость белков в воде, так как большинство реакций протекает в цитоплазме клетки. Действительно, гидрофобные радикалы аминокислотных остатков могут быть спрятаны внутрь глобулы, а в воду экспонированы (направлены) гидрофильные остатки.
3) Для обеспечения компактной трехмерной структуры белок должен обладать элементами вторичной структуры небольшой протяженности, соединенных неструктурированными участками полипептидной цепи. Эти участки позволяют белку сворачиваться в компактную глобулу.
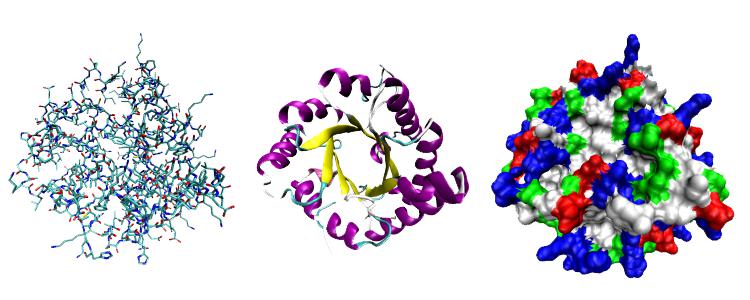
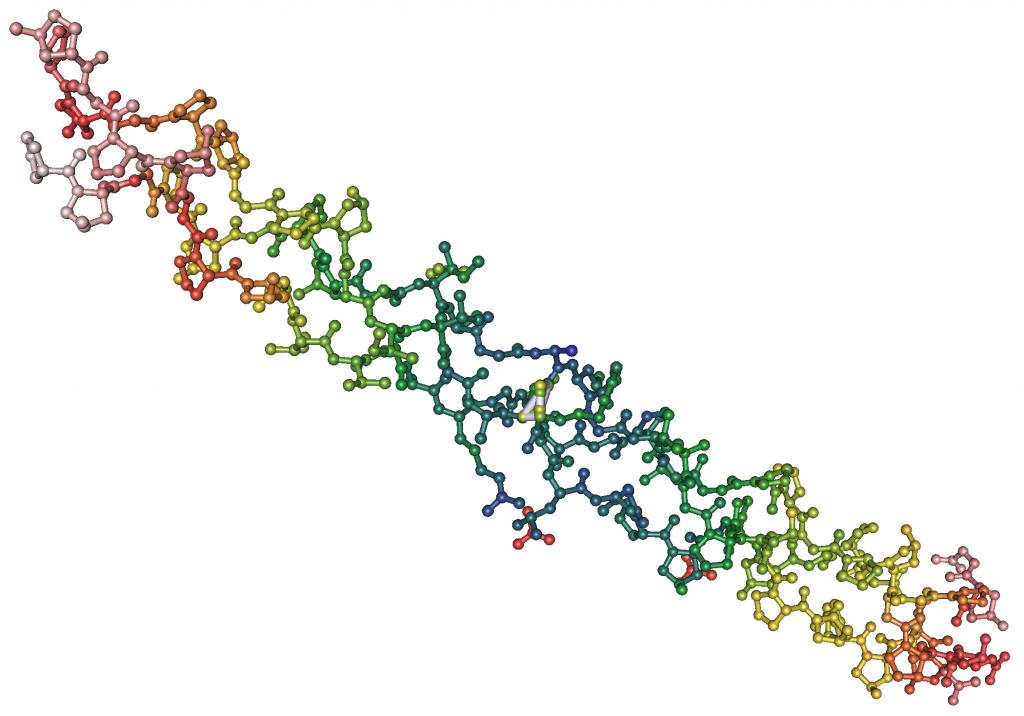
Рассмотрим особенности строения глобулярных белков на примере белка, обладающего ферментативной активностью – рибонуклеазы А Рис. 2.5):
Рис. 2.5. Третичная структура рибонуклеазы А
Структура рибонуклеазы А (одна цепь, 128 аминокислотных остатков) построена преимущественно из β-слоев. Тем не менее, основные принципы организации остаются прежними. Дисульфидные связи (4) вместе с большим числом водородных связей (72 связи) служат каркасом молекулы и скрепляют структуру в плотную глобулу.
2.3. Простые и сложные белки
По степени сложности состава молекулы белка выделяют простые и сложные белки.
Простым белкам называются белки, которые при гидролизе дают только аминокислоты.
Сложными называются белки, которые при гидролизе дают не только аминокислоты, но также и другие органические и неорганические соединения.
2.3.1. Простые белки
Альбумины. Молекула альбуминов состоит из одной полипептидной цепи и насчитывает до 600 аминокислотных остатков. Благодаря повышенному содержанию аспарагиновой и глутаминовой кислот, эти белки хорошо растворимы в воде.
Примерами их могут служить: альбумин белка куриного яйца, альбумин кровяной сыворотки, альбумин мышечной ткани, молочный альбумин. Выполняют транспортные и питательные функции.
Глобулины. Они нерастворимы в воде, но растворяются в очень слабых растворах солей. Эти белки являются очень слабыми кислотами. Примерами глобулинов могут служить: фибриноген, глобулин кровяной сыворотки, глобулин мышечной ткани, глобулин белка куриного яйца. Выполняют транспортную и защитную функцию.
Гистоны. Гистоны – глобулярные белки, локализованы в ядрах соматических клеток. Плохо растворимы в воде, но хорошо растворяются в солевых растворах. Белки характеризуются повышенным содержанием положительно заряженных аминокислот – лизина и аргинина (от 15 до 30%), поэтому являются белками основного характера. Выполняют структурную и регуляторную функцию.
Протамины. Протамины также относятся к глобулярным ядерным белкам, но локализованы в ядрах половых клетках. Не растворимы в воде, хорошо растворяются в 80% этаноле. Являются основными (положительно заряженными) белками, содержание лизина и аргинина достигает 80%. Как и гистоны, выполняют структурную и регуляторную функции
studfiles.net
Глобулярные белки - Справочник химика 21
Чем отличаются глобулярные белки от фибриллярных Каковы важнейшие функции каждого из них [c.342]Глобулярные белки включают гормоны, ферменты и транспортные белки. Все они двигаются внутри клетки нли переносятся кровью. Такой тип передвижения предполагает растворимость в воде. Поэтому в глобулярных структурах гидрофобные неполярные группы находятся внутри, а ионные полярные — снаружи. [c.453]
Главное различие между цепями белка и полиэтилена или полиэтилен-терефталата (дакрона) заключается в том, что в молекуле белка не все боковые группы одинаковы. У фибриллярных белков определенная повторяющаяся последовательность боковых групп придает конкретному белку-кератину или коллагену-вполне конкретные механические свойства. Глобулярные белки имеют еще более сложное строение. Эти молекулы обычно содержат от 100 до 500 аминокисло г, полимеризованных в одну длинную цепь, и полная последовательность аминокислотных остатков в каждой молекуле одного глобулярного белка одинакова. Эти остатки могут быть углеводородными, кислыми, основными, нейтральными или полярными. Свертывание белковой цепи в компактную глобулярную моле- [c.313]
Белки-это полимеры аминокислот. Фибриллярные белки являются основным структурным материалом волос, кожи, ногтей, мышц и сухожилий. В этих структурах белковые цепи свернуты спиралями в многожильные тяжи или связаны друг с другом водородными связями в листы. Глобулярные белки включают ферменты, молекулы-переносчики и антитела. В белках этого типа цепи могут иметь вид спиралей или листов, но затем эти структуры многократно перегибаются, сворачиваясь в компактные, изолированные молекулы. [c.338]
Рис. 21-17. а-Спираль, тип свертывания белковой цепи, обнаруживаемый как в фибриллярных, так и в глобулярных белках. -Спираль была предсказана Л. Полингом и Р. Кори на основе экспериментов по модельному построению белков с учетом длин связей и валентных углов, полученных в результате рентгеноструктурных исследований отдельных аминокислот и полимеров из двух-трех аминокислот. Впоследствии эта структура была обнаружена в белках волос и шерсти, в кератине кожи и в таких глобулярных белках, как миоглобин и гемоглобин. [c.316]
В белке волос и шерсти, а также других кератинах а-спирали многократно скручены друг с другом в многожильные тяжи, которые образуют видимые глазом нити. Цепи белков шелка вытянуты во всю длину (а не свернуты в спираль) и соединены с параллельными цепями водородными связями в листы, показанные на рис. 21-2,а. В глобулярных белках цепи не являются полностью вытянутыми или полностью свернутыми в а-спираль чтобы молекула имела компактную структуру, она должна быть надлежащим образом деформирована. В молекуле миоглобина (см. рис. 20-25) 153 аминокислоты белковой цепи свернуты в восемь витков а-спирали (обозначенные на рисунке буквами А-Н), которые в свою очередь свернуты так, что в результате получается компактная молекула. Витки Е и Р образуют карман, в котором помещается группа гема, и молекула кислорода может связываться с атомом железа этого гема. Подобным же образом построена молекула гемоглобина, которая состоит из четырех миоглобиновых единиц (см. рис. 20-26). Небольшой белок цитохром с (см. рис. 20-23) имеет меньше места для витков а-спирали. 103 аминокислоты этого белка свернуты вокруг его группы гема подобно кокону, оставляя к ней доступ только в одном месте. У более крупных ферментов, например трипсина (223 аминокислоты) и карбоксипептидазы (307 аминокислот) в центре молекулы имеются области, где белковая цепь делает ряд зигзагов, образуя несколько параллельных нитей, скрепленных водородными связями подобно тому, как это имеет место в молекуле шелка. [c.317]
Какое влияние оказывают водородные связи на структуру глобулярного белка Какое влияние оказывают на его структуру гидрофобные радикалы [c.342]
Форма белковой цепи определяет функции белка в клетке или организме. Некоторые белки сворачиваются в клубок (глобулярные белки). Другие остаются развернутыми для них характерно взаимодействие боковых групп соседних цепей с образованием плоских илн линейных структур (фибриллярные белки, рис. У11.8 . [c.453]
Уравнение Эйнштейна означает, что характеристическая вязкость раствора сплошных невзаимодействующих частиц (не обязательно сферических, тогда коэффициент 2,5 будет другим) определяется только плотностью вещества и не зависит от молекулярной массы и размеров частиц. Это происходит вследствие того, что масса таких частиц строго пропорциональна их объему. При этом т]пр постоянна в широком интервале концентраций, поскольку частицы предполагаются невзаимодействующими. Уравнению Эйнштейна (в первом приближении) подчиняются разбавленные растворы глобулярных белков разных молекулярных масс. Для всех этих систем [ti] са 0,04 дл/г независимо от молекулярной массы полимера. [c.99]
Поверхность глобулярных белков представлена нерегулярно расположенными группами близких друг к другу полярных атомов, между которыми находятся небольшие островки неполярной поверхности [138]. Поэтому в аддитивных расчетах в работе [161] использовались значения вкладов, характерных для сближенных полярных групп. Вклады неполярных атомных групп учитывались пропорционально их доступной поверхности. Вклады заряженных групп учитывались без каких-либо поправок. На рис. 3.12 приведены вычисленные значения Д/С>г в виде отрезков, отложенных вниз от /См. Видно, что экспериментальные значения гидратационных эффектов по абсолютной величине в среднем на 30% ниже вычисленных. Следовательно, на поверхности глобулярного белка нет кооперативных эффектов, усиливающих гидратационный эффект сжимаемости по сравнению с низкомолекулярными соединениями. [c.60]
Глобулярные белки (от латинского слова 1оЬи1а — шарик) состоят из макромолекул шаровидной, эллипсовидной, реже веретенообразной формы. Характерной особенностью этих белков является хорошая растворимость в воде, т. е. высокая гидрофильность. Глобулярные белки находятся главным образом в биологических жидкостях в крови, лимфе, протоплазме клеток. Белки этой группы — альбумины, а также глобулины яичного белка, молока, сыворотки крови, пепсин желудочного сока и другие — выполняют в организме очень важные биологические функции. [c.338]
Наиболее важный класс глобулярных белков образуют биологические катализаторы, ферменты. Они характеризуются каталитическим механизмом, позволяющим им ускорять достижение конкретной реакцией состояния термодинамического равновесия, а также специфичность к субстрату, благодаря которой они способны делать выбор между потенциальными молекулами субстратов, воздействуя на одни из них и отказываясь воздействовать на другие. Участок поверхности фермента, на котором происходит катализ, называется активным центром. Механизм катализа может осуществляться при помощи заряженных групп, доноров и акцепторов электрона или протона, а также при помощи атомов металла в активном центре фермента. Избирательность ферментов обусловливается формой их поверхности и характером взаимодействия с субстратом, например водородной связью, электростатическим взаимодействием или гидрофобным притяжением. Фермент и его субстрат соответствуют друг другу по форме и размеру, как ключ и замок. [c.339]
Характерная особенность структуры мицелл — это гидрофобное ядро, образованное углеводородными цепями молекул ПАВ, окруженное гидрофильным слоем их головных групп. Этим создается некоторое подобие мицеллярной структуры со структурой глобулярных белков (см. гл. I). Однако если белковая глобула — это относительно жесткое и весьма неоднородное образование, то мицелла ПАВ, напротив, носит псевдожидкий характер [1001 и образована совершенно идентичными молекулами ПАВ. Хотя эти различия и накладывают существенные ограничения на использование мицелл как моделей ферментов [1011, с другой стороны, именно благодаря простоте в построении мицелл в мицеллярных системах наиболее четко и достоверно могут быть прослежены такие эффекты, как стабилизация переходного состояния химической реакции за счет дополнительных сорбционных взаимодействий (или же сближение реагентов при их концентрировании), далее сдвиг р/Са реагирующих групп и влияние микросреды на скорость реакции. [c.115]
В глобулярных белках одно или большее число полипептидных цепей свернуты в плотную компактную структуру сферической или глобулярной формы. К белкам данного типа относятся почти все ферменты, транспортные белки крови, антитела, а также пищевые белки. [c.425]
Исключение составляют макроскопические монокристаллы глобулярных белков, в узлах решетки которых располагаются отдельные белковые глобулу. Подобные кристаллы для синтетических линейных полимеров неизвестны, и их структура здесь не рассматривается. [c.172]
Оценить радиус глобулярного белка цитохрома с (молекулярный вес 13000), если его коэффициент диффузии в воде при 20° С равен 1,01-10- см /сек. Вязкость воды в условиях опыта равна 0,89 спз. [c.271]
МИД, возникают положительно заряженные поверхности, образованные катионными головками ПАВ. Под действием кулоновских сил притяжения ионы брома собираются вблизи четвертичных атомов азота. Вокруг мицеллы формируется так называемый слой Штерна, где и проявляются наиболее интересные особенности химии мицелл. Внутри мицелла содержит очень мало молекул воды и образует углеводородное ядро. Именно это различие в полярности между внутренней частью и поверхностью делает мицеллы сходными с глобулярными белками. Полярность мицеллярных поверхностей в общем случае близка к полярности белков и занимает промежуточное положение менаду водой и этанолом. Поскольку активный центр фермента, очевидно, вовсе не полярен, даже когда фермент растворим в воде, весьма полезно и необходимо изучение мицелл [154, 155]. [c.284]
Белковые вещества классифицируют также по форме их молекул, подразделяя на две группы а) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму к ним относят фиброин шелка, кератин шерсти б) глобулярные белки, молекулы которых имеют округлую форму к ним относятся, например, альбумины, глобулины и ряд других, в том числе и сложные белки. [c.298]
В последние годы М. Перутц, Д. Кендрью и другие исследователи установили, что для части глобулярных белков четвертичная структура создается отнюдь не образованием нескольких пластов субъединиц, а за счет их своеобразного расположения в пространстве. Так, четвертичная структура гемоглобина очень проста и симметрична четыре субъединицы расположены как бы на вершинах тетраэдра. [c.179]
В петлях цитоскелета находятся разнообразные глобулярные белки, молекулы которых при развертывании сами могут превращаться в скелетные образования. Внутри цитоскелета находятся и другие органические и неорганические вещества, а также вода. Протоплазма живой клетки представляет собой полифазную коллоидную систему, состоящую из высокомолекулярных соединений, диспергированных в водной среде. [c.402]
В настоящее время, как известно, твердые тела используются в радио- и микроэлектронике как многофункциональные устройства. Отметим, что сформулированная проблема относится и к молекулярной биологии. Молекулы глобулярных белков (гемоглобина, пепсина и др.) обладают достаточно жесткой структурой, испытывающей определенные трансформации при выполнении этими молекулами специфических функций в биохимических процессах жизнедеятельности организмов. [c.9]
Фибриллярные белки, в том числе волос, кожи, мышц и ногтей, выполняют струкпурные функции. Глобулярные белки, такие, как ферменты и гормоны, делают специфическую биохимическую работу. Сравните форму молекул и растворимость в воде этих двух классов белков. Почему растворимость в воде для фибриллярных белков часто так сильно отличается от растпоримости в воде глобулярных белков [c.457]
Внешнее поле глобулы защищено (экранировано) гидратными оболочками. Глобулярные макромолекулы между собой не сцепляются. В растворах глобулярных веществ внутреннего каркаса не образуется. Поэтому растворы глобулярных белков не застудневают. [c.279]
Глобулярные белки Белки, молекулы котс ых свернуты в шарообразную структуру. Такие белки растворимы в воде, так как их полярные группы обращены наружу, а неполярные спрятаны внутрь глобулы [c.544]
Молекула глобулярного белка имеет цилиндрическую форму, причем диаметр цилиндра может быть равен его высоте. [c.361]
Макроструктура глобулярного белка. [c.178]
Поверхность фибриллярных и глобулярных белков имеет большое количество гидрофильных групп, создающих вокруг этих макроструктур почти сплошную водную оболочку. Гидрофобные радикалы аминокислот, образующих полипептидные цепи, обращены, видимо, преимущественно внутрь структуры. Тем не менее неко- [c.203]
Наличие в молекулах полиэлектролнтов групп различной природы определяет возможность возникновения взаимодействий разных видов (электростатических, гидрофобных, водородных связей) и повышенную по сравнению с нейтральными полимерами склонность цепей полиэлектролитов к конформационным изменениям при изменении pH, температуры раствора, природы растворителя. Об изменении конформации макромолекул можно судить по значению параметра а уравнения Марка — Куна — Хаувинка [т]] = = КМ . Известно, что а зависит от конформации макромолекул в растворе и изменяется от нуля для очень компактных клубков до 2 для палочкообразных частиц. Для многих глобулярных белков а = 0. В растворе сильного полиэлектролита при достаточно высокой ионной силе раствора а = 0,5, т. е. цепь имеет конформацию статистического клубка с уменьшением ионной силы параметр а увеличивается и при ионной силе, близкой к нулю, стремится к а = 2. Для слабого полиэлектролита в заряженной форме, а также для полипептидов в конформации а-спирали а = = 1,5—2. [c.123]
Более того, спирали образунэт даже более сложные по структуре глобулярные белки. Английские химики Макс Фердинанд Перутц [c.130]
Неполярные взаимодействия (рис. VII.9,в) - относительно слабые взаимодействия между неполярными группами R. Они часто имеют место внутри шарообразных глобулярных белков. Но несмотря на их слабость, они помогают сохранять структуру молекулы, предотврашая попадание внутрь молекул воды. [c.455]
Здесь собственный вклад молекулы Хм в случае полностью развернутого полимера может быть принят равным сумме вкладов атомных групп или мономеров. В случае компактных макромолекул (глобулярные белки) величина Хм возрастает, поскольку значительная часть атомных групп скрыта от растворителя и участвует во внутримолекулярных взаимодействиях. Вклад релаксации от свободных движений звеньев полимера Xret может быть сравнительно малым в случае компактных макромолекул и заметно возрастать в развернутых полимерах. Эти два вклада необходимо учитывать для правильной оценки гидратационного эффекта AXh полимера. [c.58]
По данным работ [161. 196]. Горизонтальной пунктирной линией вверху обозначена собственная удельная сжимаемость глобулы (средняя по всем глобулярным белкам). —эксперимент. О — аддитивный расчет. Стрелки, направленные вниз, означают величину гидратационного вклада в К 1М для глобулярных белков она отсчитывается от значения сжимаемости глобулы, для полностью развернутых цепей — от нуля, поскольку в этом случае собственная сжимаемость молекулы отражает ничтожно малую сжимаемость вандер-ваальсовых объемов аминокислотных остатков. / — рибонуклеаза 2 — лизоцим 3 — миоглобин — полиглутаминовая кислота 5 — поли-0,1-аланин — коллаген нативный [161, 202] 7 — коллаген деструктурированный (желатина) [200] [c.59]
Глобулярные белки. Систематические исследования парциальной сжимаемости глобулярных белков проводились в ряде работ [161, 190, 199—201], но только в работе [161] выполнен анализ аддитивности гидратационного эффекта поверхности нескольких белков (рибонуклеазы, лизоцима и миоглобина). Экспериментальные значения приведены на шкале удельных парциальных сжимаемостей (рис. 3.12). Это положительные величины, так как отрицательный гидратационный член АКп с избытком компенсируется большим положительным вкладом собственной сжимаемости /См (релаксационный вклад Кте1 не учитывается в анализе, так как он мал, как было показано в работе [200]). Величина /См/М определена в работах [161, 190] как средняя для всех глобулярных белков, и ее значение 10 м (г-Па) приведено на рис. 3.12. Отклонение экспериментального значения парциальной сжимаемости белка от величины /См характеризует гидратационный вклад, который можно сравнивать с величиной, полученной на основании аддитивных расчетов. [c.60]
Все белки являются полимерами аминокислот. Общая формула такого полимера показана в нижней части рис. 21-1, а модель отдельной аминокислоты-на рис. 21-12. Ферменты представляют собой один из классов белков, причем, видимо, наиболее важный. Ферменты имеют компактные молекулы с молекулярной массой от 10000 до нескольких миллионов и диаметром от 20 А и выше. Они выполняют роль катализаторов, регули-руюидах биохимические реакции. Другие компактные молекулы белков, например миоглобин и гемоглобин, выполняют роль переносчиков и накопителей молекулярного кислорода (см. рис. 20-25, 20-26). Цитохромы-это белки, способные к окислительно-восстановительным реакциям и играющие роль промежуточных звеньев при извлечении энергии из пищевых продуктов (см. рис. 20-23). Молекулы гамма-глобулинов с молекулярной массой порядка 160000 представляют собой так называемые антитела, защитное действие которых заключается в том, что они присоединяются к вирусам, бактериям и другим чужеродным телам в живом организме и осаждают их из жидких сред. Все перечисленные белки относятся к глобулярным белкам. [c.313]
Глобулярные белки (сферопротешы) Полипептидные цепи, образующие клубки меньшая часть их состоит из простых аминокислотных остатков в большинстве случаев растворимы в воде [c.211]
Структура а-сггарали является наиболее важным и широко распространенным случаем организации молекул глобулярных белков (например, ферменты). Структура р-складчатого слоя встречается в фибриллярных белках типа фиброина шелка и р-кератина (кожа, волосы, ногти, рога, копыта и т.д.). [c.271]
Существуют и некристаллические упорядоченные структуры. По причинам, которые изложены ниже, довольно бессмысленно их систематизировать, за исключением, разве что, глобул, которые вполне дискретны, но не обязательно обладают внутренним дальним порядком. Дело в том, что путаница, царящая в монографической и журнальной литературе по поводу надмолекулярных структур, особенно в некристаллизующихся полимерах, обусловлена пренебрежением принципами статистической физики и физической кинетики. Описание полимеров на всех уровнях структурной организации не может быть полным, если наряду с морфологией не учитывается подвижность соответствующих структурных элементов . А введение подвижности ав томатически требует, при описании надмолекулярной организации в целом, не только описания пространственного распределения и -сил взаимосвязи структурных элементов, но и усреднения во времени (ср. стр. 45). При этом сразу выявляется третий признак классификации структур по их стабильности. Как известно, по отношению к так называемой денатурации все глобулярные белки принято подразделять на кинетически и термодинамически стабильные. ЭтОт же принцип должен реализоваться и по отношению к надмолекулярным уровням структурной организации полимеров. Все дискретные организованные структуры являются термодинамически стабильными отдельные организованные морфозы (типа сферолитов, например) могут обладать определенной — и регистрируемой, (см. гл. VII) — внутренней и внешней подвижностью, но ниже температуры фазового перехода они вполне устойчивы в отсутствие внешних силовых полей их время жизни т->оо. [c.47]
Вычислить, во сколько раз будут различаться коэффициенты диффузии глицина (мол. вес 75) и глобулярного белка уреа-зы (мол. вес 480 ООО) в воде. [c.271]
Водородный показатель рН о, устанавливающийся в растворе чистого белка, характеризует изоионную точку. Очень часто она близка к изоэлектрической. Различие между ними увеличивается, если снижается концентрация белка, так как изоэлектрическая точка не зависит от концентрации полиэлектролита. В изоэлектрической точке электростатическое притяжение между противоположно заряженными частями макромолекул глобулярных белков выражается всего сильнее. В таком состоянии макромолекулы стремятся принять наиболее плотную клубковую упаковку, и растворимость их становится минимальной. Так как в достаточно концентрированных растворах изоионная точка близка к изоэлектрической, то тщательной очисткой раствора от примесных электролитов можно выделить белок из раствора. Для этой цели удобен метод электродиализа. [c.215]
К другой группе — сферопротеинам (они называются также глобулярными белками) — относятся белки, третичная структура которых напоминает сферические объекты. Они встречаются во всех видах тканей и имеют самое разное назначение. Так, многие из них являются ферментами, другие — антителами. В крови (а также в мышцах, молоке и яйцах) присутствуют альбумины и глобулины. В ядрах клеток содержатся гисто-ны. Тромбин участвует в превращении растворенного в крови [c.194]
К составным белкам, а конкретно к металлопротеидам, относятся близкие по своей структуре миоглобин и гемоглобин. Эти глобулярные белки содержат небелковую компоненту, пигмент крови —гел1 (разд. 7.9.2.4), и поэтому называются также гемопротеидами. Имеющиеся в теме двухвалентное железо способно связывать молекулярный кислород или диоксид углерода, поэтому оба белка осуществляют перенос этих газов в крови (гемоглобин) и мышцах (миоглобин). Степень окисления железа при таком переносе не изменяется, и оно остается двухвалентным. Структура миоглобина более простая, чем структура гемоглобина. Оба этих белка имеют красную окраску (присутствующий в мышцах миоглобин обусловливает их красную окраску, подобно тому как гемоглобин в красных кровяных тельцах обусловливает красный цвет крови). В растительном мире (Rhizobium) известен гемопротеид — леггемоглобин, который по своей структуре близок к миоглобину. [c.195]
Характер связей одинаков в фибриллярных и глобулярных белках. Молекулярный вес обоих основных структурных видов белка также примерно одинаков (от 30 ООО до 1 000 000 и более), но форма значительно отличается. У фибриллярных белков длина макроглобул в сотни и тысячи раз превышает их толщину так, макроглобула проколлагена с молекулярным весом 680 ООО имеет длину 3000 А при толщине несколько ангстрем. Глобулярные белки имеют чаще не шарообразную, а веретенообразную форму, варьирующую у разных белков. Длина глобул обычно не превышает 300 А, а средний объем составляет 44 000 А . [c.180]
Поверхность фибриллярных и глобулярных белков имеет большое количество гидрофильных групп, создающих вокруг этих макроструктур почти сплошную водную оболочку. Гидрофобные радикалы аминокислот, образующих полипептидные цепи, обращены, видимо, преимущественно внутрь структуры. Тем не менее некоторые количества воды связаны (иммобилизованы) и внутри их 1) диполи воды могут вклиниваться в водородные связи, не нарушая их прочности 2) гидрофильные группы содержатся и во внутренних отделах макроструктур белков, где связывают определенное количество воды 3) некоторое количество воды замкнуто внутри белковых молекул в своеобразных сотах , образованных гидратированными полипептидными цепочками. Благодаря этому различают интрамицеллярную воду, находящуюся внутри белковых глобул, и интермицеллярную воду, находящуюся в свободном состоянии между ними. Для устойчивости коллоидных частиц имеет значение только вода, создающая внешнюю водную оболочку, препятствующую столкновению и объединению частиц. [c.180]
Органическая химия (1968) -- [ c.438 ]Органический синтез. Наука и искусство (2001) -- [ c.419 , c.477 ]
Органическая химия. Т.2 (1970) -- [ c.669 , c.710 ]
Химия (1978) -- [ c.384 ]
Принципы структурной организации белков (1982) -- [ c.108 , c.116 ]
Органическая химия (1979) -- [ c.656 ]
Органический синтез (2001) -- [ c.419 , c.477 ]
Принципы структурной организации белков (1982) -- [ c.108 , c.116 ]
Биоорганическая химия (1991) -- [ c.376 ]
Органическая химия (1964) -- [ c.590 ]
Энциклопедия полимеров Том 2 (1974) -- [ c.119 , c.120 ]
Энциклопедия полимеров Том 3 (1977) -- [ c.2 , c.119 , c.120 ]
Молекулярная биология клетки Том5 (1987) -- [ c.136 , c.144 ]
Энциклопедия полимеров Том 2 (1974) -- [ c.119 , c.120 ]
Энциклопедия полимеров Том 3 (1977) -- [ c.2 , c.119 , c.120 ]
Основы биохимии Т 1,2,3 (1985) -- [ c.79 , c.140 , c.141 , c.165 , c.181 , c.187 , c.188 , c.189 , c.190 , c.191 , c.192 , c.193 , c.194 , c.195 , c.196 , c.197 , c.198 , c.199 , c.200 , c.201 , c.202 , c.203 , c.204 , c.205 , c.206 , c.207 , c.208 , c.209 , c.210 , c.211 , c.212 , c.213 , c.214 , c.215 , c.216 , c.217 , c.218 , c.219 , c.220 , c.221 , c.222 , c.223 , c.224 ]
Успехи стереохимии (1961) -- [ c.320 ]
Органическая химия Углубленный курс Том 2 (1966) -- [ c.655 , c.694 ]
Органическая химия 1971 (1971) -- [ c.442 ]
Органическая химия 1974 (1974) -- [ c.366 ]
Химия полимеров (1965) -- [ c.72 , c.79 ]
Химия высокомолекулярных соединений Издание 2 (1966) -- [ c.456 ]
Химические волокна (1961) -- [ c.86 , c.238 , c.249 , c.256 , c.257 ]
Курс органической химии (0) -- [ c.396 ]
Органическая химия (1964) -- [ c.590 ]
Курс органической химии (1955) -- [ c.333 ]
Биология Том3 Изд3 (2004) -- [ c.129 , c.131 , c.135 , c.153 ]
Химия высокомолекулярных соединений (1950) -- [ c.469 , c.472 ]
Химия биологически активных природных соединений (1970) -- [ c.24 , c.153 , c.195 ]
Биохимия Издание 2 (1962) -- [ c.34 ]
chem21.info
ГЛОБУЛЯРНЫЕ БЕЛКИ - это... Что такое ГЛОБУЛЯРНЫЕ БЕЛКИ?
ГЛОБУЛЯРНЫЕ БЕЛКИ ГЛОБУЛЯРНЫЕ белки - белки, в молекулах которых полипептидные цепи плотно свернуты в компактные шарообразные структуры - глобулы. К глобулярным белкам относятся ферменты, антитела, некоторые гормоны и многие другие белки, выполняющие в клетках динамические функции. Ср. Фибриллярные белки.Большой Энциклопедический словарь. 2000.
- ГЛОБУЛЫ
- ГЛОБУС
Смотреть что такое "ГЛОБУЛЯРНЫЕ БЕЛКИ" в других словарях:
ГЛОБУЛЯРНЫЕ БЕЛКИ — белки, полипептидные цепи к рых свёрнуты в компактные сферические или эллипсоидные структуры (глобулы). Важнейшие представители Г. б. альбумины, глобулины, протамины, гистоны, проламины, глутелины. В отличие от фибриллярных белков, играющих гл.… … Биологический энциклопедический словарь
глобулярные белки — – белки, имеющие цилиндрическую или сферическую форму, хорошо растворимы в воде … Краткий словарь биохимических терминов
глобулярные белки — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры глобулы. К глобулярным белкам относятся ферменты, антитела, некоторые гормоны и многие другие биологически активные белки. Ср. Фибриллярные белки.… … Энциклопедический словарь
Глобулярные белки — Трехмерная структура молекулы гемоглобина глобулярного белка Глобулярные белки белки, в молекулах которых полипептидные цепи плотно свёрнуты в ком … Википедия
ГЛОБУЛЯРНЫЕ БЕЛКИ — белки, в молекулах к рых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры глобулы. К Г. б. относятся ферменты, антитела, нек рые гормоны и мн. др. биологически активные белки. Ср. Фибриллярные белки … Естествознание. Энциклопедический словарь
Глобулярные белки — (от лат. globulus шарик) кристаллические хорошо растворимые в воде или слабых растворах солей Белки; форма молекул у них близка к шарообразной (отношение осей сферы не превышает 5). Такое строение молекул обеспечивается спирализацией… … Большая советская энциклопедия
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
dic.academic.ru