Гликолиз. Аэробный путь расщепления углеводов. Энергетика процессов. Анаэробный и аэробный гликолиз
Обмен и функции углеводов. Анаэробное и аэробное окисление глюкозы
15.2.1. Гликолиз – это ферментативный распад глюкозы в аэробных условиях до двух молекул пировиноградной кислоты (аэробный гликолиз), а в анаэробных условиях – до двух молекул молочной кислоты (анаэробный гликолиз). В анаэробных условиях гликолиз протекает в тканях без потребления кислорода и является единственным процессом, поставляющим АТФ, так как окислительное фосфорилирование в этих условиях не функционирует. Анаэробный гликолиз происходит во всех тканях, функционирующих в условиях гипоксии, прежде всего в скелетных мышцах. Гликолиз в эритроцитах даже в присутствии кислорода завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии.
Гликолиз протекает в цитозоле клеток организма. Этот процесс катализируется одиннадцатью ферментами, которые выделены в высокоочищенном состоянии и хорошо изучены. Условно можно разделить гликолиз на две стадии.
15.2.2. Первая стадия гликолиза является подготовительной и включает реакции превращения молекулы глюкозы в две молекулы фосфотриоз. Эта стадия сопровождается затратой молекул АТФ.
Начальной реакцией превращения глюкозы в клетке является её фосфорилирование в результате взаимодействия с АТФ (рисунок 15.1, реакция 1). Эта реакция в условиях клетки протекает только в одном направлении. Биологическая роль реакции фосфорилирования глюкозы заключается в том, что глюкозо-6-фосфат, в отличие от свободной глюкозы, не может проникать через плазматическую мембрану обратно в кровь и оказывается «запертой» в клетке. Таким образом, глюкозо-6-фосфат является ключевым метаболитом углеводного обмена, на уровне которого осуществляется интеграция различных путей превращения глюкозы в клетке.
В большинстве тканей реакцию фосфорилирования глюкозы катализирует фермент гексокиназа, которая обладает высоким сродством к глюкозе, способна также фосфорилировать фруктозу и маннозу и аллостерически ингибируется избытком глюкозо-6-фосфата. В клетках печени, кроме того, есть фермент глюкокиназа, которая имеет низкое сродство к глюкозе, не ингибируется глюкозо-6-фосфатом и не участвует в фосфорилировании других моносахаридов. Глюкокиназа эффективно функционирует только при высокой концентрации глюкозы в крови. Это способствует усвоению большого количества углеводов, поступающих в печень из кишечника в активную фазу пищеварения.
В следующей реакции глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат (рисунок 15.1, реакция 2).
Продукт реакции изомеризации подвергается повторному фосфорилированию за счёт АТФ (рисунок 15.1, реакция 3). Эта реакция – наиболее медленно протекающая реакция гликолиза и, подобно фосфорилированию глюкозы, необратима. Фермент – фосфофруктокиназа – является аллостерическим, активируется АДФ, АМФ, и фруктозо-2,6-бисфосфатом, а ингибируется цитратом и высокой концентрацией АТФ.
На следующем этапе фруктозо-1,6-дифосфат подвергается расщеплению на две фосфотриозы (рисунок 15.1, реакция 4). Таким образом, химическое соединение, содержащее 6 углеродных атомов, превращается в два, содержащих по 3 атома углерода. Поэтому гликолиз называют дихотомическим путём превращения глюкозы (от слова «дихотомия» – рассечение на две части).
Далее происходит изомеризация триозофосфатов (рисунок 15.1, реакция 5). В этой реакции диоксиацетонфосфат переходит в глицеральдегид-3-фосфат. Таким образом, в первой стадии гликолиза молекула глюкозы превращается в две молекулы глицеральдегид-3-фосфата. Поэтому в реакциях второй стадии глюкозы будет участвовать по две молекулы каждого субстрата, что необходимо учитывать при расчёте энергетического баланса данного метаболического пути.
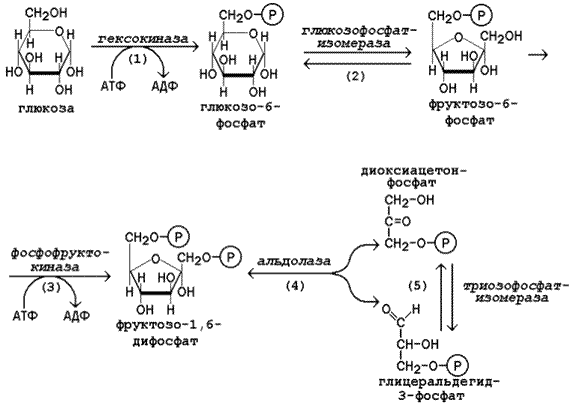
Рисунок 15.1. Реакции первой стадии гликолиза.
15.2.3. Вторая стадия гликолиза включает реакции превращения двух молекул глицеральдегид-3-фосфата в две молекулы лактата. На этой стадии гликолиза происходит синтез молекул АТФ.
Глицеральдегид-3-фосфат подвергается дегидрированию при участии НАД-зависимой дегидрогеназы. В этой реакции происходит потребление неорганического фосфата, который включается в состав продукта реакции, содержащего макроэргическую фосфатную связь (рисунок 15.2, реакция 6), а промежуточным донором водорода служит SH-группа в активном центре фермента, которая потом регенерирует.
1,3-Дифосфоглицерат вступает в реакцию первого субстратного фосфорилирования, т.е. не сопряжённого с переносом электронов в дыхательной цепи. В этой реакции осуществляется синтез молекулы АТФ в результате переноса фосфатной группы вместе с макроэргической связью на молекулу АДФ (рисунок 15.2, реакция 7).
В следующей реакции происходит внутримолекулярное перемещение фосфатной группы 3-фосфоглицерата ко 2-му углеродному атому (рисунок 15.2, реакция 8). Тем самым облегчается последующее отщепление молекулы воды, которое приводит к появлению в продукте реакции макроэргической фосфатной связи (рисунок 15.2, реакция 9).
Фосфоенолпируват (ФЕП) вступает в реакцию второго субстратного фосфорилирования, в ходе которого образуется молекула АТФ. В отличие от первого субстратного фосфорилирования, данная реакция является необратимой в условиях клетки (рисунок 15.2, реакция 10). Фермент пируваткиназа существует в двух изоферментных формах. Изофермент, присутствующий в печёночных клетках, аллостерически ингибируется АТФ и активируется фруктозо-1,6-дифосфатом. Изофермент, присутствующий в головном мозге, мышцах и других тканях, не является аллостерическим и не принимает участия в регуляции гликолиза.
В заключительной реакции гликолиза происходит использование НАДН, образовавшегося при дегидрировании глицеральдегид-3-фосфата (см. реакцию 6). При участии НАД-зависимой лактатдегидрогеназы пируват восстанавливается в молочную кислоту (рисунок 15.2, реакция 11). Фермент существует в пяти изоферментных формах, отличающихся сродством к субстрату и распределением в тканях.
 Рисунок 15.2. Реакции второй стадии гликолиза.
Рисунок 15.2. Реакции второй стадии гликолиза.
Таким образом, в процессе образования лактата из глюкозы в клетке не накапливается НАДН. Это значит, что данный процесс является анаэробным и может протекать без участия кислорода (который является конечным акцептором электронов, передаваемых НАДН в дыхательную цепь). В тканях, функционирующих в условиях гипоксии,
При подсчёте энергетического баланса гликолиза следует учитывать, что каждая из реакций второй стадии этого метаболического пути повторяется дважды. Таким образом, в первой стадии было затрачено 2 молекулы АТФ, а во второй стадии путём субстратного фосфорилирования образовалось 2х2 = 4 молекулы АТФ; следовательно при окислении одной молекулы глюкозы в клетке накапливается 2 молекулы АТФ.
dendrit.ru
Гликолиз. Аэробный путь расщепления углеводов. Энергетика процессов.
Гликолиз – последовательность ферментативных реакций, приводящих к расщеплению глюкозы с образованием ПВК, сопровождающихся образованием АТФ (в цитозоле клетки). Различают два вида гликолиза – аэробный и анаэробный.
Аэробный гликолиз: образуется ПВК, поступающая в митохондрии. В аэробных условиях ПВК далее, в общем пути катаболизма, распадается до СО2 и Н2О. Аэробный гликолиз – часть аэробного распада глюкозы.
1). Фосфорилирование глюкозы. Реакцию катализирует гексокиназа, в паренхиматозных клетках печени - глюкокиназа. Образование глюкозо-6-фосфата в клетке - ловушка для глюкозы, т.к. мембрана для фосфорилированной глюкозы непроницаема. Глюкозо-6-фосфат - аллостерический ингибитор реакции.
2).Реакция изомеризации при участии глюкозо-6-фосфатизомеразы:
3) Лимитирующая стадия- реакция фосфорилирования, катализируемая 6-фосфофруктокиназой, которая ингибируется АТФ и цитратом, активируется - АМФ.
4). Реакция альдольного расщепления при участии альдолазы.
5). Изомеризация диоксиацетонфосфата, фермент – триозофосфатизомераза:
1 молекула глюкозы превращается в 2 молекулы глицеральдегид-3-фосфата (реакции 4, 5).
6). Реакция окисления, фермент - глицеральдегидфосфатдегидрогеназа:
7). Субстратное фосфорилирование при участии фосфоглицераткиназы:
8). Внутримолекулярный перенос фосфатной группы, фермент - фосфоглицеромутаза:
9). Реакция дегидратации при участии енолазы:
10). Субстратное фосфорилирование, фермент - пируваткиназа:
Выход АТФ при аэробном распаде глюкозы:полный аэробный распад глюкозы включает аэробный гликолиз, продуктом которого является пируват, и реакции общего пути катаболизма.
В аэробном гликолизе за счет субстратного фосфорилирования образуется 2АТФ. Также на 1 молекулу глюкозы образуется 2НАДН+Н+, и в результате в дыхательной цепи синтезируется 2х3АТФ = 6АТФ.
Общий путь катаболизма на одну молекулу ПВК дает 15 АТФ, на 2 – 30.
Итого:
2АТФ +6АТФ + 30АТФ = 38АТФ.
Анаэробный гликолиз. Примеры, энергетика процессов.
Анаэробный гликолиз: образуется ПВК, которая затем превращается в лактат. Анаэробный гликолиз протекает в первые минуты мышечной работы, в эритроцитах (нет митохондрий), при недостаточном поступлении кислорода. Реакции гликолиза:
Реакции гликолиза:
1). Фосфорилирование глюкозы. Реакцию катализирует гексокиназа, в паренхиматозных клетках печени - глюкокиназа. Образование глюкозо-6-фосфата в клетке - ловушка для глюкозы, т.к. мембрана для фосфорилированной глюкозы непроницаема. Глюкозо-6-фосфат - аллостерический ингибитор реакции.
2).Реакция изомеризации при участии глюкозо-6-фосфатизомеразы:
3) Лимитирующая стадия- реакция фосфорилирования, катализируемая 6-фосфофруктокиназой, которая ингибируется АТФ и цитратом, активируется - АМФ.
4). Реакция альдольного расщепления при участии альдолазы.
5). Изомеризация диоксиацетонфосфата, фермент – триозофосфатизомераза:
1 молекула глюкозы превращается в 2 молекулы глицеральдегид-3-фосфата (реакции 4, 5).
6). Реакция окисления, фермент - глицеральдегидфосфатдегидрогеназа:
7). Субстратное фосфорилирование при участии фосфоглицераткиназы:
8). Внутримолекулярный перенос фосфатной группы, фермент - фосфоглицеромутаза:
9). Реакция дегидратации при участии енолазы:
10). Субстратное фосфорилирование, фермент - пируваткиназа:
11). В анаэробных условиях протекает реакция восстановления пирувата в лактат под действием фермента лактатдегидрогеназы:
Суммарное уравнение анаэробного гликолиза:
Анаэробный гликолиз не нуждается в дыхательной цепи.
Выход АТФ при анаэробном гликолизе: АТФ образуется за счет двух реакций субстратного фосфорилирования: из 1,3-бисфосфоглицерата – 7 реакция, и из фосфоенолпирувата – 10 реакция. Учитывая, что 1 молекула глюкозы расщепляется на 2 триозы и дает 2 молекулы глицеральдегидфосфата, образуется 4АТФ. 2АТФ расходуется на активацию глюкозы (реакции 1 и 3 гликолиза). Суммарно:
4АТФ - 2АТФ = 2АТФ
cyberpedia.su
Анаэробное окисление глюкозы — SportWiki энциклопедия
Анаэробное окисление глюкозы: гликолиз с образованием АТФ и лактата[править]
Анаэробный гликолиз[править]

 Рис. 17.1. Анаэробный метаболизм глюкозы и гликогена с образованием АТФ
Рис. 17.1. Анаэробный метаболизм глюкозы и гликогена с образованием АТФ 
 Рис. 17.2. Цикл Кори. В мышцах глюкоза преобразуется в лактат. Лактат поступает в печень, где снова превращается в глюкозу глюкоза снова поступает в мышцы
Рис. 17.2. Цикл Кори. В мышцах глюкоза преобразуется в лактат. Лактат поступает в печень, где снова превращается в глюкозу глюкоза снова поступает в мышцы При отсутствии кислорода (т.е. в анаэробных условиях из глюкозы можно получить 2 молекулы АТФ. Однако сначала потребуется израсходовать АТФ в гексокиназной и фосфофруктокиназной реакциях. Фруктозо-6-фосфат в итоге расщепляется на 2 молекулы глицеральдегид-3-фосфата, которые затем окисляются глицеральдегид-3-фосфатдегидрогеназой с образованием двух молекул НАДН. Две молекулы АТФ образуются в фосфоглицераткиназной реакции, еще две молекулы АТФ в пируват киназной реакции. Примечание: в аэробных условиях НАДН, окисляясь в дыхательной цепи, образует НАД+, глицеральдегид-3-фосфатдегидрогеназной реакции (следу помнить, что НАДН и НАД+ представлены в клетке в небольших количествах и всегда должны рециклировать). Однако анаэробных условиях НАДН используется лактатдегидрогеназой для восстановления пирувата, а образовавшийся НАД снова используется глицеральдегид-3-фосфатдегидрогеназой. В лактатдегидрогеназной реакции образуется лактат, который с током крови транспортируется в печень и поступает в цикл Кори, где из него в ходе глюконеогенеза синтезирует глюкоза (рис. 17.2).
Обратите внимание, что когда источником глюкозо-6-фосфата выступает гликоген, общий выход АТФ в анаэробном гликолизе составляет 3 молекулы (табл. 17.2)
Таблица 17.1. При анаэробном гликолизе из одной молекулы глюкозы образуются 2 молекулы АТФ
| Выход АТФ при анаэробном окислении глюкозы до лактата | ||
| Реакция | НАДН или ФАДН2 | Выход АТФ |
| 1 Гексокиназа (или глюкокиназа в печени) | -1 | |
| 2 Фосфофруктокиназа-1 | -1 | |
| 3 З-Фосфоглицераткиназа | 2 | |
| 4 Пируваткиназа | 2 | |
| Итого | 2 | |
Таблица 17.2. При анаэробном гликолизе из одного глюкозного остатка гликогена образуются 3 молекулы АТФ
| Выход АТФ при анаэробном окислении одного глюкозного остатка гликогена до лактата | ||
| Реакция | НАДН или ФАДН2 | Выход АТФ |
| 2 Фосфофруктокиназа-1 | -1 | |
| 3 З-Фосфоглицераткиназа | 2 | |
| 4 Пируваткиназа | 2 | |
| Итого | 3 | |
Метаболизм лактата: цикл Кори[править]
Лактат постоянно образуется из глюкозы в процессе анаэробного гликолиза в эритроцитах, сетчатке и мозговом веществе почек. Этот лактат снова превращается в глюкозу в цикле Кори. Лактат переносится в печень и превращается в глюкозу в процессе глюконеогенеза. Образование глюкозы из лактата требует затраты 6 молекул АТФ. Если из-за поражения печени цикл Кори блокируется, в организме накапливается лактат и развивается гиперлактатемия. Гиперлактатемия часто протекает бессимптомно, и это весьма распространенное состояние, не представляющее угрозы для жизни. Лишь в редких случаях развивается лактацидоз, с которым не справляются буферные системы организма.
sportwiki.to
Гликолиз
Гликолиз
Гликолиз – процесс распада одной молекулы глюкозы с выделением энергии, достаточной для "зарядки" двух молекул АТФ, протекает в саркоплазме под воздействием 10 специальных ферментов.
C6h22O6 + 2h4PO4 + 2АДФ = 2C3H6O3 + 2АТФ + 2h3O.
Гликолиз может протекать без потребления кислорода (такие процессы называются анаэробными) и с потреблением кислорода (аэробный гликолиз) способен быстро восстанавливать запасы АТФ в мышце.
При занятиях бодибилдингом и высокоинтенсивных упражнениях происходит анаэробный гликолиз, с образованием молочной кислоты.
Во время динамических нагрузок, таких как бег, плавание и т.п., происходит аэробный гликолиз.
Аэробный гликолиз происходит в митохондриях под воздействием специальных ферментов и требует затрат кислорода, а соответственно и времени на его доставку. Окисление происходит в несколько этапов, сначала идет гликолиз, но образовавшиеся в ходе промежуточного этапа этой реакции две молекулы пирувата не преобразуются в молекулы молочной кислоты, а проникают в митохондрии, где окисляются в цикле Кребса до углекислого газа СО2 и воды Н2О и дают энергию для производства еще 38 молекул АТФ. Суммарное уравнение реакции окисления глюкозы выглядит так:
C6h22O6 + 6O2 + 38АДФ + 38h4PO4 = 6CO2 + 44h3O + 38АТФ
Распад глюкозы по аэробному пути (аэробный гликолиз) дает энергию для восстановления 38 молекул АТФ. Аэробное окисление в 19 раз эффективнее анаэробного гликолиза.
 Подробное описание в статье: Энергообеспечение мышечной деятельности
Подробное описание в статье: Энергообеспечение мышечной деятельности
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора

 Рис. 18.1. Анаэробный гликолиз в эритроцитах
Рис. 18.1. Анаэробный гликолиз в эритроцитах 
 Рис. 18.2. Образование 2,3-бисфосфоглицерата в эритроцитах
Рис. 18.2. Образование 2,3-бисфосфоглицерата в эритроцитах Эритроциты транспортируют большое количество кислорода, которым снабжают все органы человека. По иронии судьбы сами они не могут использовать этот кислород. Источником энергии для эритроцитов служит глюкоза, при окислении которой в ходе анаэробного гликолиза в эритроцитах образуется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритроцитах невозможно, так как в них отсутствуют митохондрии и вместе с ними все ферменты цикла Кребса. Кроме того, в них отсутствуют также ферменты, необходимые для окисления жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем органам и тканям организма. Гемоглобин эритроцитов прочно связывается с кислородом, образуя оксигемоглобин. Однако в периферических тканях эритроциты должны отдав этот кислород другим клеткам. Это осуществляется благодаря явлению, известному под названием эффекта Бора. Эффект Бора создается благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2).
- Протоны вытесняют кислород из оксигемоглобина
Работающим мышцам необходим АТФ, и поэтому в них интенсивно функционирует цикл Кребса. В цикле Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту (эту реакцию катализирует карбоангидраза). Угольная кислота самопроизвольно диссоциирует, образуя бикарбонат и протон. что приводит к местному возрастанию концентрации протонов (Н+), т.е. понижению pH. Протоны высвобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Здесь он связывается с миоглобином и переносит кислород в дыхательную цепь, где он используется для синтеза АТФ путем окислительного фосфорилирования.
- Высвобождение кислорода в периферических тканях: 2,3-бисфосфоглицерат (2,3-БФГ) стабилизирует структуру дезоксигемоглобина. Помимо протонов, в создании эффекта Бора принимает участие 2,3-бисфосфоглиисрат (2.3-БФГ) (рис. 18.2). В медицинской литературе распространено и другое название этого вещества — 2,3-дифосфоглицерат (2,3-ДФГ). 2.3-БФГ образуется в анаэробных условиях в эритроцитах. Процесс образования 2,3-БФГ происходит в дополнительной реакции гликолиза, получившей название
2,3-БФГ-шунта (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и стабилизирует его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина.
- Связывание гемоглобина с кислородом в легких. Эритроциты переносят дезоксигемоглобин и связанный с ним СО2 в легкие. Поскольку в легких имеет место высокое парциальное давление кислорода, он вытесняет С02 из гемоглобина, и С02 выходит из легких при выдохе. Кислород связывается с гемоглобином, образуя оксигемоглобин, 2,3-БФГ вытесняется, и эритроциты переносят к периферическим тканям следующую порцию кислорода.
2.3- БФГ в норме и при патологии
Эмбриональный гемоглобин имеет низкое сродство к 2,3-БФГ
Гемоглобин — тетрамер. состоящий из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин имеет иное строение: он состоит из двух а-цепей и двух у-цепей. По сравнению с нормальным гемоглобином взрослого человека, фетальный гемоглобин имеет более низкое сродство к 2,3-БФГ. Это значит, что сродство к кислороду у фетального гемоглобина выше, чем у гемоглобина материнского организма. Благодаря этому происходит транспорт кислорода от материнского организма к азолу.
2.3- БФГ и высотная адаптация
Предположим, что некий житель низин решил провести отпуск в горах. В первые дни отпуска даже незначительные физические нагрузки вызовут у него усталость и одышку. Но за несколько дней произойдет адаптация к высокогорью — в эритроцитах повысится концентрация 2,3-БФГ. Благодаря этому ткани станут получать кислород в достаточном количестве. несмотря на то что его концентрация в разреженном горном воздухе невысока. Повышение концентрации 2,3-БФГ — ответная реакция организма на недостаток кислорода
У курящих лиц концентрация 2,3-БФГ в эритроцитах выше, чем у некурящих. Так организм компенсирует сниженное вследствие постоянного воздействия угарного газа обеспечение тканей кислородом. Компенсаторное повышение уровня 2.3- БФГ также часто наблюдается у больных хроническими анемиями, обструктивной болезнью легких, при врожденных пороках сердца и муковисцидозе.
Энзимопатии гликолитического пути в эритроцитах
В редких случаях из-за врожденной недостаточности гликолитических ферментов в эритроцитах развивается наследственная несфероцитарная гемолитическая анемия. Это заболевание может быть весьма тяжелым, поскольку в эритроцитах гликолиз — единственный путь синтеза и АТФ и 2.3-БФГ.
Нарушения гликолитического ферментативного аппарата могут по-разному сказываться на метаболизме 2.3-БФГ (рис. 18.2). Если нарушение расположено проксимально по отношению к 2.3-БФГ-шунту (например, при недостаточности гексокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет снижен, так как будет снижена интенсивность синтеза его предшественников. Если же нарушение расположено после 2.3-БФГ-шунта (например, недостаточность пируваткиназы). концентрация 2.3-БФГ в эритроцитах будет повышена.
Кроме того, у ряда больных была обнаружена недостаточность бифункционального фермента шунта — БФГ-мутазы/2,3-БФГ-фосфагазы. У таких больных концентрация 2.3- БФГ была низкой.
Номенклатура альдолаз
Чтобы учащийся не путал разные термины, необходимо разобраться в номенклатуре альдолаз. Альдолаза (полное название — фруктозо-1,6-бисфосфат-атьдолаза) по официальной номенклатуре называется D-глицеральдегид-З-фосфатлиазой (КФ 4.1.2.13). Она выполняет три функции:
- катализирует реакцию конденсации дигидрокснацетон-фосфата и глицеральдегид-З-фосфата. Продукт этой реакции — фруктозо-1,6-бисфосфат;
- катализирует расщепление фруктозо-1,6-бисфосфата на лигилроксиацетонфосфат и минеральдегид-3-фосфат;
- катализирует расщепление других, структурно близких фосфатов сахаров. Так. альдолаза катализирует расщепление фруктозо-1-фосфата на дигидроксиацетонфосфат и глицеральдегид (примечание: раньше фермент, выполняющий эту функцию, называли кетозо-1-фосфат-альдолазой. КФ 4.1.2.7).
У животных обнаружены три формы альдолазы.
Альдолаза А. Содержится в эритроцитах и мышцах. При наследственной гемолитической анемии в крови содержится дефектная форма альдолазы А.
Альдолаза В. Недостаточность альдолазы В приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике.
Альдолаза С. Содержится в головном мозге.
Взаимосвязь гликолиза и аэробных реакций
Два способа оценки аэробных возможностей организма (прямая оценка показателя максимального устойчивого состояния по лактату и косвенная оценка аэробно-анаэробного перехода) основаны на классической теории активации гликолиза, предложенной А. Хиллом. В основу этой теории легла гипотеза о том, что активация гликолиза в мышечном волокне запускается при снижении аэробного ресинтеза АТФ. Основной причиной снижения аэробного ресинтеза АТФ должно быть неадекватное снабжение клетки кислородом, т.е. фактически снижение внутриклеточного парциального давления кислорода до критического уровня (0,1—0,5 мм рт. ст.), ниже которого нормальное функционирование митохондрий невозможно. Прямо проверить данное предположение оказалось методически достаточно сложно.
Относительно недавно появились исследования, в которых in situ было измерено внутримышечное парциальное давление кислорода, связанного с миоглобином, во время максимального теста с возрастающей нагрузкой в т. gracilis у собаки методом криомикроспектроскопии. Среднее парциальное давление кислорода, связанного с миоглобином, при работе на уровне МПК значительно выше критического и составляет 5,5 мм рт. ст., при этом не удается обнаружить связь между ПК мышцей или средним парциальным давлением кислорода в волокне и концентрацией лактата в мышце или суммарным выходом лактата из мышцы.
Сходные результаты получены при измерении внутримышечного парциального давления кислорода во время максимального теста с повышающейся нагрузкой (50-100% от пикового ПК) у тренированных велосипедистов в условиях in vivo при разгибании ноги в коленном суставе. Исследователи получили достаточно неожиданный результат. Оказалось, что парциальное давление кислорода в миоглобине не изменяется на протяжении всего теста с возрастающей нагрузкой (50—100% от пикового ПК) вплоть до отказа от работы. Среднее парциальное давление кислорода, связанного с миоглобином, составляет 3,1 мм рт. ст. Любопытно, при работе в гипоксических условиях (F,02—0,12) парциальное давление кислорода, связанного с миоглобином, оказывается достоверно ниже, чем в нормоксии и составляет 2,1 мм рт. ст. Оно также не изменяется во всем диапазоне нагрузок (50~100% от пикового ПК). При этом потребление кислорода тканями рабочей ноги, измеренное с помощью прямого метода (по Фику), линейно растет вплоть до отказа от работы, как в гипоксических, так и в нормоксических условиях.
Таким образом, даже при гипоксии во время максимальной нагрузки парциальное давление кислорода в миоглобине не падает ниже критического уровня. Однако при этом наблюдается увеличение скорости суммарного выхода лактата из рабочей мышцы, измеренное с помощью прямого метода. Причем работа в условиях гипоксии приводила к значительно более интенсивному выходу лактата (относительно нормированной мощности работы), чем работа в нормоксических условиях. На основании этих данных можно сделать вывод о том, что парциальное напряжение кислорода в активной мышечной клетке не является ключевым фактором, активирующим гликолиз. В то же время опыты с гипоксией дают основание полагать, что парциальное давление кислорода в цитоплазме может модулировать активность гликолиза. Увеличение суммарного выхода лактата из мышцы, как в условиях нормоксии, так и в условиях гипоксии, регулируется, главным образом, активацией симпато-адреналовой системы. Это подтверждается сходной динамикой концентрации адреналина в артериальной крови и суммарного выхода лактата из рабочей мышцы. Влияние симпато-адреналовой системы на гликолиз подтверждается и рядом других работ, в которых исследовали изменения концентрации катехоламинов во время нагрузки, а также опытами с применением бета-блокаторов.
Среди других возможных кандидатов на роль активаторов гликолиза выделяют: АДФ, АМФ, неорганический фосфат, отношение креатин/фосфокреатин и цитоплазматический окислительно-востановительный потенциал (НАДН+/НАД+).
Суммируя результаты описанных исследований, можно сказать, что парциальное давление кислорода в цитоплазме мышечной клетки не опускается до критичного уровня даже при работе максимальной аэробной мощности. Это означает, что активность гликолиза в мышечном волокне во время работы не зависит от скорости аэробного ресинтеза АТФ или, по крайней мере, зависит не только от нее.
Читайте также
sportguardian.ru
понятие, этапы, общая схема, последовательность реакций, регуляция, энергетический баланс. Регуляция гликолиза — Мегаобучалка
Анаэробный гликолиз – это процесс окисления глюкозы до лактата, протекающий в отсутствии О2.
Анаэробный гликолиз отличается от аэробного только наличием последней 11 реакции, первые 10 реакций у них общие.
Этапы:
1) Подготовительный, в нем затрачивается 2 АТФ. Глюкоза фосфорилируется и расщепляется на 2 фосфотриозы;
2) 2 этап сопряжён с синтезом АТФ. На этом этапе фосфотриозы превращаются в ПВК. Энергия этого этапа используется для синтеза 4 АТФ и восстановления 2НАДН2, которые в анаэробных условиях восстанавливают ПВК до лактата.
Энергетический баланс:2АТФ = -2АТФ + 4АТФ
Общая схема:
Происходит окисление 1 глюкозы до 2 молекул молочной кислоты с образованием 2 АТФ (сначала 2 АТФ затрачиваются, затем 4 образуются). В анаэробных условиях гликолиз является единственным источником энергии. Суммарное уравнение: С6Н12О6 + 2Н3РО4 + 2АДФ → 2С3Н6О3 + 2АТФ + 2Н2О.
Реакции:
Общие реакции аэробного и анаэробного гликолиза
1) Гексокиназав мышцах фосфорилирует в основном глюкозу, меньше – фруктозу и галактозу.Ингибитор глюкозо-6-ф, АТФ. Активатор адреналин. Индуктор инсулин.
Глюкокиназа фосфорилирует глюкозу. Активна в печени, почках. Не ингибируется глюкозо-6-ф. Индуктор инсулин.
2) Фосфогексозоизомераза осуществляет альдо-кетоизомеризацию открытых форм гексоз.
3) Фосфофруктокиназа 1 осуществляет фосфорилирование фруктозы-6ф. Реакция необратима и самая медленная из всех реакций гликолиза, определяет скорость всего гликолиза. Активируется: АМФ, фруктозо-2,6-дф, фруктозо-6-ф, Фн. Ингибируется: глюкагоном, АТФ, НАДН2, цитратом, жирными кислотами, кетоновыми телами. Индуктор реакции инсулин.
4) Альдолаза А действует на открытые формы гексоз, образует несколько изоформ. В большинстве тканей содержится Альдолаза А. В печени и почках – Альдолаза В.
5) Фосфотриозоизомераза.
6) 3-ФГА дегидрогеназа катализирует образование макроэргической связи в 1,3-ФГК и восстановление НАДН2.
7) Фосфоглицераткиназа осуществляет субстратное фосфорилирование АДФ с образованием АТФ.
8) Фосфоглицератмутаза осуществляет перенос фосфатного остатка в ФГК из положения 3 положение 2.
9) Енолаза отщепляет от 2-ФГК молекулу воды и образует высокоэнергетическую связь у фосфора. Ингибируется ионами F-.
10) Пируваткиназа осуществляет субстратное фосфорилирование АДФ с образованием АТФ. Активируется фруктозо-1,6-дф, глюкозой. Ингибируется АТФ, НАДН2, глюкагоном, адреналином, аланином, жирными кислотами, Ацетил-КоА. Индуктор: инсулин, фруктоза.
Образующаяся енольная форма ПВК затем неферментативно переходит в более термодинамически стабильную кетоформу.
Реакция анаэробного гликолиза
11) Лактатдегидрогеназа. Стоит из 4 субъединиц, имеет 5 изоформ.
Лактат не является конечным продуктом метаболизма, удаляемым из организма. Из анаэробной ткани лактат переноситься кровью в печень, где превращаясь в глюкозу (Цикл Кори), или в аэробные ткани (миокард), где превращается в ПВК и окисляется до СО2 и Н2О.
megaobuchalka.ru
Анаэробный гликолиз - Большая Энциклопедия Нефти и Газа, статья, страница 1
Анаэробный гликолиз
Cтраница 1
Анаэробный гликолиз как один из источников энергии для мышечного сокращения играет особо важную роль в белых мышцах. Большинство скелетных мышц содержит как белые, так и красные волокна, однако есть и такие мышцы, которые состоят почти целиком из одних только красных или одних только белых волокон. У индеек мышцы крыла белые и летать они могут лишь на очень короткие расстояния. У лошади, способной к длительному непрерывному бегу, мышцы ног состоят преимущественно из красных волокон. Белые мышечные волокна, содержащие мало митохондрий, отличаются чрезвычайно высо-кой частотой сокращений. Источником АТР служит для них анаэробный гликолиз, так что работать с максимальной интенсивностью они могут лишь очень короткое время, поскольку имеющийся в них запас гликогена используется малоэффективно. [1]
Анаэробный гликолиз происходит не в митохондриях, но зато именно там протекают последующие стадии дыхания - цикл Кребса ( называемый также циклом трикарбоновых кислот и циклом лимонной кислоты) и конечное дыхание. Эти реакции изучены до мельчайших подробностей. [2]
Анаэробный гликолиз - примитивный и единственно возможный способ получения энергии из глюкозы облигатными анаэробами, хотя он и имеет место у факультативных анаэробов, а также характерен для типичных анаэробных клеток. [3]
Анаэробным гликолизом называется распад глюкозы до молочной кислоты в отсутствие кислорода. [4]
Хотя анаэробный гликолиз быстрее, чем аэробный обмен веществ, он очень неэкономичен в расходовании топлива организма. Кроме того, образующаяся при гликолизе молочная кислота накапливается в мышцах, вызывая боль, которую вы, возможно, чувствовали, пробежав несколько лестничных пролетов. Предел времени - в течение которого ваше тело может получать энергию в результате анаэробного гликолиза, меньше минуты. [5]
Изучение анаэробного гликолиза на препарате мышечной ткани показало, что при использовании в качестве субстрата гликогена лактат не образуется, тогда как добавление глюко-зо-1 - фосфата-или глюкозы приводило к нормальному гликолизу с образованием лактата. [6]
Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме ( цитозоле) клетки. [7]
Решающее значение анаэробного гликолиза для черепахи в условиях аноксии впервые ясно продемонстрировал Белкин. Он использовал в качестве метаболического яда иодацетат, действие которого проявляется главным образом на уровне триозо-фосфатдегидрогеназной реакции гликолиза. Если в условиях аноксии за выживание ответствен гликолиз, то ингибирование этого фермента путем инъекции черепахе иодацетата должно было бы резко уменьшить ее выносливость по отношению к аноксии. [9]
АТФ при анаэробном гликолизе равен нулю: два эквивалента АТФ используются гексокиназой и фосфофруктокиназой соответственно и два регенерируются фосфоглицераткиназои и пиру-ваткиназой. Поскольку на этапах фосфоглицераткиназы и пируваткиназы образуются при этом 2 моля АТФ, то в итоге чистый выход АТФ составляет в этом случае 1 моль АТФ на 1 моль глюкозы. [11]
Таким образом, анаэробный гликолиз дает дополнительное количество АТР сверх того основного количества, которое вырабатывается при аэробном окислении других субстратов энергетического обмена в цикле лимонной кислоты. [13]
Очень интересный анализ сравнительной роли анаэробного гликолиза у крупных животных, в основе которого лежат экспериментальные наблюдения над аллигаторами и другими животными. [14]
В последнее время выделяют аэробный гликолиз и анаэробный гликолиз. [15]
Страницы: 1 2 3 4
www.ngpedia.ru











