Получение водорода электролизом воды. Схема водорода
Строение атома водорода (H), схема и примеры
Общие сведения о строении атома водорода
Относится к неметаллам. Заряд ядра равен 1. Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
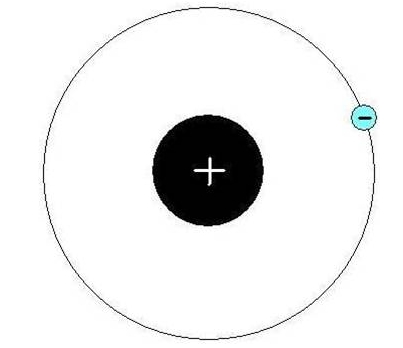
Рис. 1. Схема строения атома водорода.
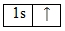
Электронная конфигурация атома водорода будет выглядеть следующим образом:
1s1.
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H+/Н—):
H0 –e →H+;
H0 +e →H—.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Урок 26. Получение водорода и его применение – HIMI4KA
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.

Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
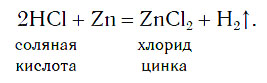
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
 Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:

Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:

Существуют и другие промышленные способы получения водорода.
Применение водорода
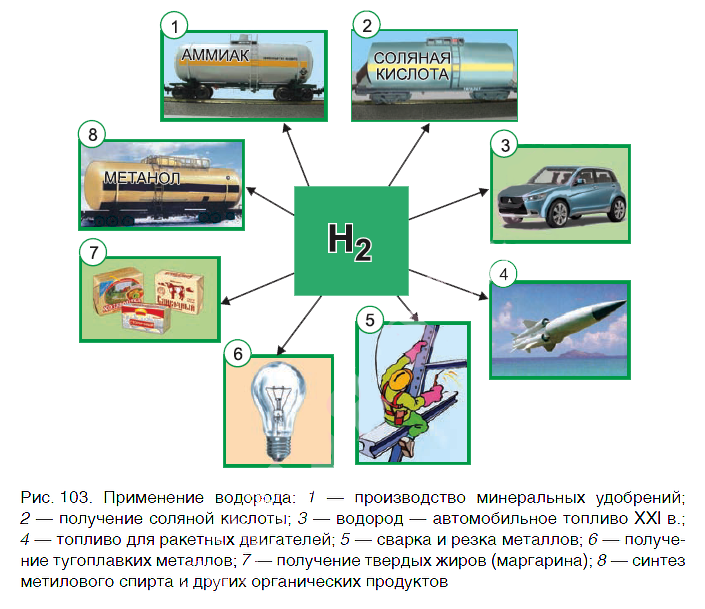
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака Nh4. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
himi4ka.ru
Получение водорода использованием резонанса воды
 Водород можно получать облучением воды ВЧ колебаниями.
Водород можно получать облучением воды ВЧ колебаниями.
Джон Канзиус (John Kanzius) показал, что раствор NaCl-h3O с концентрацией, колеблющейся от 1 до 30%, когда его облучают направленным поляризованным (polarisedradiofrequency) ВЧ излучением с частотой, равной резонансной частоте раствора, порядка 13,56 МГц, при комнатной температуре начинает выделять водород, который в смеси с кислородом, начинает устойчиво гореть. При наличии искры водород воспламеняется и горит ровным пламенем, температура которого, как показывают эксперименты, может превышать 1600 градусов Цельсия.Удельная теплота сгорания водорода: 120 Мдж/кг или 28000 ккал/кг.Пример схемы ВЧ генератора:

Катушка диаметром 30-40 мм изготавливается из одножильного изолированного провода диаметром 1 мм, число витков 4-5 (подбирается эксперименально). Настойка в резонанс поизводится переменным конденсатором. Катушка наматывется поверх сосуда с соленой водой цилиндрической формы. Сосуд на 75-80% заливается соленой водой и плотно закрывается крышкой с патрубком для отвода водорода, у выхода, трубка заполняется ватой для предотвращения свободного прникновения кислорода в сосуд.
Аналогичные генераторы для получения водорода из соленой воды используют и за рубежом.Подробнее можно посмотреть на:http://www.scribd.com/doc/36600371/Kanzius-Hydrogen-by-RF
Ответ на вопрос читателя:

Реакция проходит без электролиза!
Эксперимент следует проводить осторожно, чтобы не произошло возгорание и взрыв водорода. Или сразу предусмотреть отвод водорода из накрытого крышкой сосуда с рабочими компонентами. В процессе реакции выделения водорода, через некоторое время, алюминиевая пластина начинает покрывается отходами реакции хлоридом кальция CaCl2 и окисью алюминия A12О3. Интенсивность химической реакции через некоторое время начнет снижаться.
Для поддержания её интенсивности следует удалить отходы, заменить раствор едкого натра и алюминиевую пластину на другую. Использованную, после очистки можно, применять снова и т.д. до полного их разрушения. Если применять дюраль, реакция может протекать с выделением тепла.
ГУМАНИТАРНО-ЭКОНОМИЧЕСКИЙ И ИНФОРМАЦИОННО-ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ (официальный сайт: http://www.geiti.ru/ ) приглашает Вас получить высшее образование, без отрыва от основной деятельности, обучаясь заочно.
zaryad.com
Схема водорода - Справочник химика 21
В главе II указывалось, что процесс гидрирования бензола в циклогексан можно проводить в адиабатическом реакторе, в котором поток водорода распределяется между всеми полками (см. рис. 10). В данной схеме водород на выходе реактора выделяется из реакционной смеси и поступает на вход аппарата, куда добавляют также некоторое количество свежего водорода. [c.149]В данной схеме водород играет роль газообразного катализатора. П. Сабатье и другие авторы неоднократно отмечали благоприятное действие водорода нри процессах дегидрирования, добавки водорода при этерификации спиртов повышают выход сложного эфира на 5—10%, но роль водорода остается неясной. Водород не является переносчиком или разбавителем, но непосредственно участвует в химическом процессе. Адсорбируясь на катализаторе, он образует с реагентами активированные комплексы, что способствует нормальному протеканию процесса. Как правило, при реакциях типа бескислотной этерификации, дегидроконденсациях или кето-низации первичных спиртов всегда должен присутствовать дополнительно вводимый водород, так как без него нарушается нормальное течение процесса, и катализаторы быстро теряют активность. [c.290]
Установка и стабилизация расходов газа-носителя в двух независимых линиях (в хроматографах Цвет-500 — традиционная двухколоночная схема), водорода и воздуха выполняется блоком БПГ-1Б, [c.117]
На рис. 184 схематично показано соотношение равновесных потенциалов материалов токоотводов в щелочной среде. Как видно из схемы, водород в контакте с цинком должен выделяться на стальных крышках и не будет выделяться на луженых крышках. [c.231]
Представления об образовании промежуточного комплекса между кислотой и основанием подвергались серьезной критике. Так, согласно этой схеме, водород на внешней оболочке имеет 4 электрона, что с точки зрения квантовой механики невозможно. Вероятно, механизм образования промежуточного соединения другой кислоты присоединяются к воде за счет водородной связи. [c.513]
Как видно из схемы, водород, освобожденный от СОа, сжимается до давления 175 ат и после этого осушается цеолитами в адсорбере. Осушенный и охлажденный водород промывается жидким азотом и после этого в адсорберах с активированным углем и цеолитом при низких температурах окончательно очищается от примесей, в частности метана и окиси углерода. Результаты осушки и очистки водорода показаны в табл. 17. Из приведенных данных видно, что на описанной установке достигается исключительно высокая степень очистки водорода. Стоимость очищенного цеолитами водорода, примерно, равна стоимости электролитического водорода. [c.51]
Для снижения щелочности питательной воды используется схема водород — натрий катионитового умягчения. [c.221]
При Сб-дегидроциклизации алканов и Сз-циклизациц алкенов на Pt/AbOa показано [84, 126], что скорость реакции в отсутствие Нг быстро падает, доходя фактически до нуля, и наоборот, в токе Нг проходит успешная циклизация как алканов, так и алкенов. Роль водорода при образовании циклопентанов в присутствии алюмоплатиновых катализаторов с низким содержанием Pt пока недостаточно ясна. Возможно, что влияние водорода на протекание реакции осуществляется по нескольким направлениям, часть которых обсуждалась выше. Не исключая этих возможностей и в случае нанесенных Pt-катализаторов, следует также обсудить ассоциативный механизм действия водорода [84], представляющийся авторам книги одним из наиболее вероятных. В соответствии с обсуждаемой схемой водород в случае реакции Сб-дегидроциклизации алканов играет ту же роль, что и в ряде других реакций, протекающих в присутствии металлсодержащих катализаторов, в частности в реакции миграции двойной связи в алкенах [127] и в конфигурационной изомеризации диалкилциклоалканов [128]. В этих реакциях водород входит в состав переходного комплекса, образующегося на поверхности катализатора по ассоциативной схеме. Можно полагать, что реакция Сз-дегидроциклизации, также протекающая при обязательном присутствии и, по-видимому, с участием Нг, проходит через промежуточные стадии образования и распада переходного состояния [c.230]
Получение водорода методом электролиза воды. Технологическая схема производства азотоводородной смеси для синтеза аммиака на основе электролитического водорода и азота, полученного разделением воздуха, является наиболее простой, поскольку получающиеся по этой схеме водород и азот не требуют дополнительной очистки. [c.14]
Искусственно вызываемые термоядерные процессы были пока реализованы лишь Рис. ХУ1-31. Прннци- в форме т. н. водородной бомбы, пиальная схема водород- принципиальная схема которой показана ной бомбы. на рис. ХУ -31 (АБ — атомная бомба). [c.530]
После того, как технология Пенекс НОТ вышла на коммерческий масштаб, фирма ЮОП начала подробную разработку процесса Бутамер, который изомеризирует С . На Рис.14 показана технологическая схема для Бутамер НОТ. В этой схеме, водород вводится в установку путем разбавления подпиточного газа в сырье жидкого бутана. Один до 2 моль-% водорода можно растворить в сырье жидкого бутана без сжатия подпиточного газа. Комбинированное сырье направляется в осушители жидкости, причем осушители газа устраняются. Реакции Бутамер потребляют меньше чем 1 моль-% водорода следовательно, водород присутствует на протяжении всей реакционной зоны. Эти низкие нормы потребления играют большую роль, так как водород т >ебуется для последующих реакций изомеризации. [c.78]
Очевидно, было бы невыгодно сжигать и возвращать в цикл водород из 1 и 2 ступеней, поскольку он не богаче дейтерием, чем питающая вода. Чтобы определить, на какой ступени рациональнее сжигать и возвращать водород в цикл, было просчитано несколько различных схем основные результаты приведены в последних трех столбцах табл. И. 5. По первой схеме водород сжигается и возвращается в цикл на третьей и всех последующих ступенях, по второй схеме — на четвертой и всех последующих ступенях и т. д. В каждом случае производительность по несжигаемому водороду принималась постоянной и равной 10 0000 молям. Для каждой схемы рассчитывалось [c.440]
В схеме, приведенной на рис. Ж.15,в, продуктовый поток водорода охлаждается уяе в теплообменнике холодной зоны, проходя отдельный змеевик, и после этого направляется последовательно в первую ветвь теплоосйиенника 3, конвертор 2 и затш во вторую ветвь теплообменника 3. Продуктовый поток в этом случае соответствует получаемому жидкому параводороду. В такой схеме водород нормального состава циркулирует в замкнутом контуре и выполняет роль хладагента. Кроме того, в отличие от двух первых вариантов, в которых продуктовый водород выделяется в самостоятельный поток только после теплообменника холодной зоны, в третьем варианте можно провести орто-пара конверсию частично на уровне температур жидкого азота. В случае применения схемы с двумя ступенями конверсии удельный расход энергии снижается на 0,84 кДж ч/л [З] и выработка жидкого параводорода возрастает. [c.84]
В соответствии с этой схемой водород образуется неценным путем и отношение метан водород в продуктах реакции равно длине цепи. Скорость крекинга в это1М случае [c.152]
Схема водород-катионитовой установки отличается от схемы натрий-катионитовой лишь наличием кислоторастворных баков вместо солерастворителя. [c.298]
Установка и стабилизация расходов газа-носителя в двух независимых линиях (в хроматографах Цвет-500М сохранена традиционная двухколоночная схема), водорода и воздуха выполняются блоками БПГ-1Б, БПГ-2 или БПГ-167, БПГ-175. [c.134]
Как следует из схемы, водород четыре раза используется как субстрат для восстановления углекислого газа до метана. В двойных обратных координатах экспериментальная зависимость скорости роста Ме1капоЬас1епит 1кегтоаиШгорк1сит от водорода представляет собой прямую линию (см. рис. 5.10). Это свидетельствует о том, что все четыре стадии активации водорода производятся несвязанными формами ферментов или, что то же самое, стадии ввода водорода в ферментный цикл разделены необратимыми реакциями. [c.551]
chem21.info
| ||||||||||||||||||||||||||||||||||||||||
Рис. 1 Положение водорода в периодической системе элементов | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Рис. 2 Свет звезд — это излучение, испускаемое в процессе термоядерного синтеза. Фотография сделана телескопом «Хаббл» | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Рис. 3 Образование водородных связей между молекулами фтороводорода  | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Видеоролик показывает в замедленной съемке, как происходит взрыв мыльных пузырей, наполненных водородом На английском языке | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Рис. 5 Схематичное изображение концепции водородной энергетики | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Рис. 5 Водородный топливный элемент  | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Рис. 5 Принципиальная схема автомобиля на водородных топливных элементах | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Рис. 7 Автомобиль марки Ford Edge Hybrid-2007, работающий на водородных топливных элементах | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
nscience.ru
Получение водорода электролизом воды.

Давно хотел сделать подобную штуку. Но дальше опытов с батарейкой и парой электродов не доходило. Хотелось сделать полноценный аппарат для производства водорода, в количествах для того чтобы надуть шарик. Прежде чем делать полноценный аппарат для электролиза воды в домашних условиях, решил все проверить на модели.
Общая схема электролизера выглядит так.
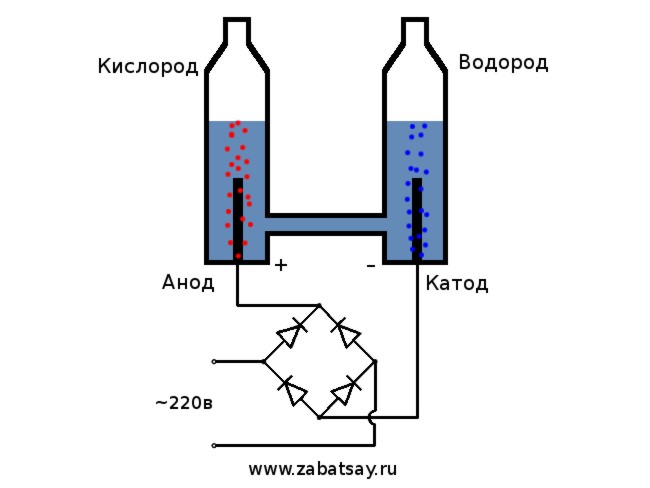
Эта модель не подходит для полноценной ежедневной эксплуатации. Но проверить идею удалось.
Итак для электродов я решил применить графит. Прекрасный источник графита для электродов это токосъемник троллейбуса. Их полно валяется на конечных остановках. Нужно помнить, что один из электродов будет разрушаться.
Пилим и дорабатываем напильником. Интенсивность электролиза зависит от силы тока и площади электродов.
К электродам прикрепляются провода. Провода должны быть тщательно изолированы.
Для корпуса модели электролизера вполне подойдут пластиковые бутылки. В крышке делаются дырки для трубок и проводов.
Все тщательно промазывается герметиком.
Для соединения двух ёмкостей подойдут отрезанные горлышки бутылок.
Их необходимо соединить вместе и оплавить шов.
Гайки делаются из бутылочных крышек.
В двух бутылках в нижней части делаются отверстия. Все соединяется и тщательно заливается герметиком.
В качестве источника напряжения будем использовать бытовую сеть 220в. Хочу предупредить, что это довольно опасная игрушка. Так что, если нет достаточных навыков или есть сомнения, то лучше не повторять. В бытовой сети у нас ток переменный, для электролиза его необходимо выпрямить. Для этого прекрасно подойдет диодный мост. Тот что на фотографии оказался не достаточно мощным и быстро перегорел. Наилучшим вариантом стал китайский диодный мост MB156 в алюминиевом корпусе.
Диодный мост сильно нагревается. Понадобится активное охлаждение. Кулер для компьютерного процессора подойдет как нельзя лучше. Для корпуса можно использовать подходящую по размеру распаячную коробку. Продается в электротоварах.
Под диодный мост необходимо подложить несколько слоев картона.
В крышке распаячной коробки делаются необходимые отверстия.
Так выглядит установка в сборе. Электролизер запитывается от сети, вентилятор от универсального источника питания. В качестве электролита применяется раствор пищевой соды. Тут нужно помнить, что чем выше концентрация раствора, тем выше скорость реакции. Но при этом выше и нагрев. Причем свой вклад в нагрев будет вносить реакция разложения натрия у катода. Эта реакция экзотермическая. В результате неё будет образовываться водород и гидроксид натрия.
Тот аппарат, что на фото выше, очень сильно нагревался. Его приходилось периодически отключать и ждать пока остынет. Проблему с нагревом удалось частично решить путем охлаждения электролита. Для этого я использовал помпу для настольного фонтана. Длинная трубка проходит из одной бутылки в другую через помпу и ведро с холодной водой.
Место подсоединения трубки к шарику хорошо снабдить краником. Продаются в зоомагазинах в отделе для аквариумов.
Процесс изготовления на видео.
Взрыв шарика с водородом
www.zabatsay.ru
Водородные станции, генераторы водорода | ЭкоГазСистем
Процесс начинается с подготовки воды. Для процесса электролиза требуется так называемая деионизованная вода (также называемая обессоленная, деминерализованная). Это совершенно чистая вода, очищенная от механических и химических загрязнений. Обычная водопроводная вода поступает в "Блок водоподготовки" по трубопроводу "Тр-4". Вода последовательно проходит несколько стадий очистки: механический фильтр, ионообменные смолы, обратный осмос. Насосный блок "Н-1" (включает два насоса – основной и резервный) подаёт готовую деионизованную воду в блок сепарации, через который вода попадает в "Блок электролиза".
"Блок электропитания" понижает сетевое напряжение и преобразует переменный ток в постоянный, который необходим для электролизера. Кроме того, блок обеспечивает электропитание для остального оборудования водородной установки.
В "Блоке электролиза" вода под действием постоянного электрического тока распадается в электролизере "Элз-1" на составляющие ее водород и кислород. Отметим, что деионизованная вода практически не проводит электрический ток. Поэтому для придания воде проводящих свойств в неё добавляют гидроксид калия (KOH). То есть в электролизере циркулирует не чистая вода, а электролит в виде 30%-го раствора KOH в воде. Кроме того, в электролит добавляют пентоксид ванадия (V₂O₅) для снижения поляризации электродов, что повышает эффективность процесса. Выделяющиеся газы (водород и кислород) далее идут по отдельным трактам. Далее рассматривается водородный тракт, кислородный тракт аналогичен водородному.
Водород из электролизера поступает в "Блок сепарации" по трубопроводу "Тр-1" в виде смеси с электролитом. Для выделения водорода от жидкости служит газожидкостный сепаратор "С-1". Сепаратор представляет собой сосуд, в который снизу подаётся электролит. Пузырьки газа выделяются из электролита, газ собирается в верхней части сосуда и уходит в трубопровод. Электролит сливается из сосуда и возвращается в блок электролиза по отдельному трубопроводу (на схеме не показан).
Водород на этом этапе содержит примеси щелочи. Для очистки от щелочи служит скруббер (промыватель) "Ск-1". Промыватель – это сосуд, в который снизу подаётся газ, а сверху из разбрызгивателя подаётся деионизованная вода. Капли воды падают вниз, очищая (промывая) встречный поток газа от капель щелочи. В верхней части сосуда установлен коалесцентный фильтр (пакет из мелкой металлической сетки). Мельчайшие капельки щелочи (туман) конденсируются в этом пакете и стекают вниз. Таким образом водород практически полностью очищается от следов щелочи. Далее вода по отдельному трубопроводу (на схеме не показан) поступает в сепаратор "С-1", а оттуда – в блок электролиза.
На данном этапе водород насыщен водяным паром и имеет довольно высокую температуру (порядка 50°С. Для его удаления служит конденсатор "К-1". Конденсатор – это теплообменник, в котором газ охлаждается хладоносителем поступающим от "Рефрижератора". Рефрижератор может быть часть оборудования водородной станции, но возможен вариант, когда хладоноситель подаётся от внешней системы охлаждения. Водяной пар конденсируется в конденсаторе после чего отводится из системы с помощью конденсатоотводчика "Ко-1". Водород, полученный на этом этапе называется "сырой", так он все еще содержит примеси воды (точка росы не ниже +3°С) и кислорода (на уровне 0,1-0,5%). Для дальнейшей очистки водород по трубопроводу "Тр-2" подаётся в "Блок очистки". Заметим, что кислород, в случае, если он не нужен потребителю, на аналогичном этапе по трубопроводу "Тр-5" сбрасывается в атмосферу.
В "Блоке очистки" водород сначала поступает в реактор каталитической очистки "Кт-1". Реактор представляет собой сосуд, заполненный мелкими гранулами катализатора на основе благородных металлов (платина, палладий). В присутствии катализатора примеси кислорода активно реагируют с водородом, обращаясь в воду. Таким образом водород практически полностью очищается от кислорода (содержание кислорода порядка 1-5 ppmv). Далее водород подаётся в осушитель "Осш-1". Осушитель действует на принципе короткоцикловой адсорбции (КЦА). В нем два попеременно работающий сосуда-адсорбера, заполненных специальным поглотителем (адсорбентом). Адсорбент поглощает влагу из газа. Сосуды-адсорберы работают попеременно – один находится в рабочем цикле, другой – в цикле регенерации. Таким образом водород осушается до точки росы -75°С, после чего подаётся потребителю.
Замечание по терминологии. В отечественной традиции используется термин "установка по производству водорода". Наравне с этим используется термин "генератор водорода", который является калькой с английского языка. Под генератором водорода обычно понимают установку, в состав которой входят: электролизер, блок сепарации, блок очистки водорода. Термином "водородная станция" обычно обозначают здание или автономный блок-контейнер, в котором размещены генератор водорода и вспомогательные агрегаты, такие как блок водоподготовки, блок электропитания, система охлаждения и прочее.
gasonsite.ru


 2h3 + O2
2h3 + O2










