Белок в пищевых продуктах. Таблица белков в продуктах питания. Типы белков таблица
Строение и функции белков

Разделы: Биология
Урок изучения нового материала в 10-м классе. Данный материал учащиеся уже изучали в 9 классе, поэтому некоторые понятия им уже известны. Соответственно с ребятами ведется диалог о строении и функциях белков. С помощью учителя учащиеся узнают о классификации ферментов.
Для того, чтобы активизировать деятельность учащихся на уроке, приводятся интересные факты о белках, которые помогают ребятам и нацеливают их на дальнейшее усвоение нового материала. Так же для этих целей предлагается провести лабораторную работу. На данном уроке основная масса изучаемого материала записывается в виде таблиц, схемы, которые учитель строит в ходе урока вместе и учениками. Качество изучаемого материала проверяется в виде фронтального опроса. Урок рассчитан как на детей-аудиалов, так и визуалов.
Цель урока: дать представление о строении и функции белков.
Задачи: продолжить расширение и углубление знаний важнейших органических веществах клетки на основе изучения строения и функции белков, сформировать знания функциях белков и их важнейшей роли в органическом мире, продолжить формирование умения выявлять связи между строением и функциями веществ.
Основные понятия: белки, протеины, протеиды, пептид, пептидная связь, простые и сложные белки, первичная, вторичная, третичная и четвертичная структуры белков денатурация.
Средства обучения: таблицы по общей биологии, иллюстрирующие строение молекул белков; лабораторное оборудование для проведения лабораторной работы “Расщепление пероксида водорода с помощью ферментов, содержащихся в плетках листа элодеи”.
Ход урока
I. Изучение нового материала.
1. Рассказ учителя (или фрагмент лекции) об особенностях строения молекул белков как биополимеров, состоящих из большого количества разных аминокислот, между которыми происходит полимеризация на основе пептидной связи. Зарисовка и запись на доске и в тетрадях учащихся.
2. Самостоятельное изучение учащимися текста учебника (С.42) о классификации белков.
3. Беседа об уровнях организации белковой молекулы и химической основы каждого из четырех уровней (структур) этой молекулы, о денатурации как утрате белковой молекулы своей природной структуры.
Структура белковой молекулы.
| Структура белка | Характеристика | Тип связи | Схема (учащиеся рисуют самостоятельно) |
| Первичная | Линейная структура – последовательность аминокислот в полипептидной цепи, которая определяет все другие структуры молекулы, а также свойства и функции белка. | Пептидная. | |
| Вторичная | Закручивание полипептидной цепи в спираль или складывание в “гармошку”. | Водородные связи. | |
| Третичная | Глобулярный белок: упаковка вторичной структуры в глобулу; фибриллярный белок: несколько вторичных структур, уложенных параллельными слоями, или скручивание нескольких вторичных структур наподобие каната в суперспираль. | Ионные, водородные, дисульфидные, гидрофобные. | |
| Четвертичная | Встречается редко. Комплекс из нескольких третичных структур органической природы и неорганическое вещество, например, гемоглобин. | Ионные, водородные, гидрофобные. |
4. Рассказ учителя о многообразии функций белков с краткой записью в тетрадях сущности функций: структурной, ферментативной, транспортной, защитной, регуляторной, энергетической, сигнальной.
5. Лабораторная работа “Расщепление пероксида водорода с помощью ферментов, содержащихся в клетках листа элодеи”.
Ход работы:
а. Приготовьте микропрепарат листа элодеи и рассмотрите его под микроскопом. б. Капните на микропрепарат немного пероксида водорода и еще раз рассмотрите, в каком состоянии находятся клетки листа элодеи. в. Объясните, с чем связано выделение пузырьков из теток листа, что это за газ, на какие вещества может расщепиться пероксид водорода, какие ферменты участвуют в этом процессе? г. Капните каплю пероксида на предметное стекло и, рассмотрев его под микроскопом, опишите наблюдаемую, картину. Сравните состояние пероксида водорода в листе элодеи и на стекле, сделайте выводы.
По завершении лабораторной работы следует провести беседу о биохимических реакциях, протекающих при участии белковых катализаторов-ферментов как основе жизнедеятельности клеток и организмов.
Химические свойства белков обусловлены их различным аминокислотным составом. Существуют белки хорошо растворимые в воде и совершенно нерастворимые, химически активные и устойчивые к действию различных агентов, способные укорачиваться и растягиваться и т. д.
Под влиянием различных факторов – высокой температуры, действия химических веществ, облучения, механического воздействия – может произойти разрушение структур белковой молекулы. Нарушение природной структуры белка называется денатурацией. Если воздействие перечисленных факторов было недолгим и несильным, то белок может вернуть свою природную структуру – обратимая денатурация (ренатурация), если же воздействие было долгим или сильным, то происходит нарушение не только третичной и вторичной структур, но и первичной – необратимая денатурация (рис. 3).
Функции белков.
| Функция | Характеристика |
| 1. Строительная (структурная). | Входят в состав клеточных мембран и органоидов клетки (липопротеиды и гликопротеиды), участвуют в образовании стенок кровеносных сосудов, хрящей, сухожилий (коллаген) и волос (кератин). |
| 2. Двигательная | Обеспечивается сократительными белками (актин и миозин), которые обуславливают движение ресничек и жгутиков, сокращение мышц, перемещение хромосом при делении клетки, движение органов растений. |
| 3. Транспортная. | Связывают и переносят с током крови многие химические соединения, например, гемоглобин и миоглобин транспортируют кислород, белки сыворотки крови переносят гормоны, липиды и жирные кислоты, различные биологически активные вещества. |
| 4. Защитная. | Выработка антител (иммуноглобулинов) в ответ на проникновение в нее чужеродных веществ (антигенов), которые обеспечивают иммунологическую защиту; участие в процессах свертывания крови (фибриноген и протромбин). |
| 5, Сигнальная (рецепторная). | Прием сигналов из внешней среды и передача команд в клетку за счет изменения третичной структуры встроенных в мембрану белков в ответ на действие факторов внешней среды. Например, гликопротеины (встроены в гликокал икс), опсин (составная часть светочувствительных пигментов родопсина и йодопсина), фитохром (светочувствительный белок растений). |
| 6. Регуляторная. | Белки-гормоны оказывают влияние на обмен веществ, т. е. обеспечивают гомеостаз, регулируют рост, размножение, развитие и другие жизненно важные процессы. Например, инсулин регулирует уровень глюкозы в крови, тироксин – физическое и психическое развитие и т.д. |
| 7. Каталитическая (ферментативная). | Белки-ферменты ускоряют биохимические процессы в клетке. |
| К. Запасающая | Резервные белки животных: альбумин (яйца) запасает воду, ферритин – железо в клетках печени, селезенки; миоглобин – кислород в мышечных волокнах, казеин (молоко) и белки семян – источник питания для зародыша. |
| 9. Пищевая (основной источник аминокислот). | Белки пищи – основной источник аминокислот (особенно незаменимых) для животных и человека; казеин (белок молока) – основной источник аминокислот для детенышей млекопитающих. |
| 10. Энергетическая. | Являются источником энергии – при окислении 1 г белка выделяется 17,6 кДж энергии, но организм использует белки в качестве источника энергии очень редко, например, при длительном голодании. |
Ферменты (энзимы) – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам, которые вступают в реакцию. Ферменты отличаются от химических катализаторов высокой степенью специфичности, т. е. фермент катализирует только одну реакцию или действует только на один тип связи. Скорость ферментативных реакций зависит от многих факторов – природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т.д.
Классификация ферментов.
| Группа | Катализируемые реакции, примеры |
| Оксидоредуктазы. | Окислительно-восстановительные реакции: перенос атомов водорода (Н) и кислорода (О) или электронов от одного вещества к другому, при этом окисляется первый и восстанавливается второй. Участвуют во всех процессах биологического окисления, например, вдыхании: АН + В А ВН (окисленный) или А + О АО (восстановленный). |
| Трансферазы. | Перенос группы атомов (метильной, ацильной, фосфатной или аминогруппы) от одного вещества к другому. Например, перенос остатков фосфорной кислоты от АТФ на глюкозу или фруктозу под действием фототрансфераз: АТФ + глюкоза глюкозо-6-фосфат + АДФ. |
| Гидролазы. | Реакции расщепления сложных органических соединений на более простые путем присоединения молекул воды в месте разрыва химической связи (гидролиз). Например, амилаза (гидролизирует крахмал), липаза (расщепляет жиры), трипсин (расщепляет белки) и др.: АВ + Н20 АОН + ВН. |
| Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, С-О, C-S. Например, декарбоксилаза отщепляет карбоксильную группу: |
| Изомеразы | Внутримолекулярные перестройки, превращение одного изомера в другой (изомеризация): глюкозо-6-фосфат глюкозо-1-фосфат. |
| Лигазы (синтетазы) | Реакции соединения двух молекул с образованием новых связей С–О, С–S, С–N, С–С, с использованием энергии АТФ. Например, фермент валин-тРНК-синтетаза, под действием которого образуется комплекс валин– тРНК: АТФ + валин + тРНК АДФ + Н3Р04 + валин-тРНК. |
Механизм действия фермента представлен на рис. 4. В молекуле каждого фермента имеется активный центр – это один или более участков, в которых происходит катализ за счет тесного контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа), или отдельная аминокислота. Активный центр может формироваться связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами или кофакторами. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (комплементарности) друг другу.
Молекула фермента изменяет глобулярную форму молекулы субстрата. Молекула субстрата, присоединяясь к ферменту, тоже в определенных пределах изменяет свою конфигурацию для увеличения реакционности функциональных групп центра.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
II. Обобщающая беседа об основополагающей роли белков как самых необходимых химических соединений для жизней деятельности всего живого на Земле.
III. Закрепление знаний в процессе беседы с помощью следующих вопросов:
- Какие органические вещества клетки можно назвать самыми важными?
- Каким образом создается бесконечное разнообразие белков?
- Что собой представляют мономеры биополимера белка?
- Как формируется пептидная связь?
- Что собой представляет первичная структура белка?
- Каким образом происходит переход первичной структуры молекул белка во вторичную, а затем– в третичную и четвертичную?
- Какие функции могут выполнять белковые молекулы?
- Чем обусловлено многообразие функций белковых молекул?
- Приведите примеры белков, выполняющих самые разные функции. При ответе можно использовать следующую схему:
Биологические функции белков.
Это интересно.
Многие молекулы очень велики и по длине, и по молекулярной массе. Так, молекулярная масса инсулина – 5700, белка-фермента рибонуклеазы – 127 ООО, яичного альбумина – 36 ООО, гемоглобина – 65 ООО. В состав различных белков входят самые разные аминокислоты. Набор всех двадцати видов аминокислот содержит: казеин молока, миозин мышц и альбумин яйца. В белке-ферменте рибонуклеазе – 19, в инсулине – 18 аминокислот. Коллективу ученых под руководством академика Ю.А. Овчинникова удалось расшифровать сложную структуру белка родопсина, ответственного за процесс зрительного восприятия.
Кровь осьминогов, моллюсков и пауков имеет голубой цвет, потому что переносчиком кислорода у них служит не красный гемоглобин, содержащий атомы железа, а гемоцианин с атомами меди.
Почти половина необходимых нам белков, углеводов, 70–80% витаминов, значительное количество минеральных солей, аминокислот и других питательных элементов содержится в хлебе.
Американские ученые выделили из растения (семейство Пентадипландовых), произрастающего в Западной Африке, белок, который слаще сахара в 2 тыс. раз. Этот шестой известный науке сладкий белок, названный бразеином, содержится в плодах, которые с большой охотой поедают местные обезьяны. Биохимики расшифровали строение молекул сладкого белка, в каждой из них содержится 54 аминокислотных остатка.
IV. Домашнее задание: Изучить § 11, ответить на вопросы на с. 46. Приготовить сообщения или рефераты на темы: “Белки – биополимеры жизни”, “Функции белков – основа жизнедеятельности каждого организма на Земле”, “Денатурация и ренатурация, ее практическое значение”, “Многообразие ферментов, их роль в жизнедеятельности клеток и организмов” и др.
Используемые ресурсы:
- Каменский А.А.Общая биология 10–11: учеб.для общеобразоват. учреждений.– М.:Дрофа, 2006.
- Козлова Т.А. Тематическое и поурочное планирование по биологии к учебнику А.А.Каменского и др. “Общая биология 10–11”. – М.: Издательство “Экзамен”, 2006.
- Биология. Общая биология. 10–11 классы: рабочая тетрадь к учебнику Каменского А.А. и др. “Общая биология 10–11”– М.: Дрофа, 2011.
- Кириленко А.А. Молекулярная биология. Сборник заданий для подготовки к ЕГЭ: уровни А,В,С: учебно-методическое пособие. – Ростов н/Д: Легион, 2011.
xn--i1abbnckbmcl9fb.xn--p1ai
| Баклажаны | 1,2 |
| Брюква | 1,2 |
| Кабачки | 0,6 |
| Капуста белокочанная | 1,8 |
| Капуста квашеная | 1,8 |
| Капуста брюссельская | 4,8 |
| Капуста кольраби | 2,8 |
| Капуста краснокочанная | 0,8 |
| Капуста цветная | 2,5 |
| Картофель | 2 |
| Картофель молодой | 2,4 |
| Картофель сладкий (батат) | 2 |
| Лук зелёный | 1,3 |
| Лук-порей | 2 |
| Лук репчатый | 1,4 |
| Морковь | 1,3 |
| Огурцы | 0,8 |
| Огурцы солёные | 0,8 |
| Пастернак (корень) | 1,4 |
| Патиссоны | 0,6 |
| Перец зелёный сладкий | 1,3 |
| Перец красный сладкий | 1,3 |
| Петрушка | 3,7 |
| Петрушка (корень) | 1,5 |
| Ревень (черешки) | 0,7 |
| Редис | 1,2 |
| Редька | 1,9 |
| Репа | 1,5 |
| Салат | 1,5 |
| Свекла | 1,5 |
| Сельдерей | |
| Сельдерей (корень) | 1,3 |
| Спаржа | 1,9 |
| Томаты | 1,1 |
| Укроп | 2,5 |
| Хрен | 2,5 |
| Черемша | 2,4 |
| Чеснок | 6,5 |
| Шпинат | 2,9 |
| Щавель | 1,5 |
| Арбуз | 0,7 |
| Дыня | 0,6 |
| Тыква | 1 |
| Абрикосы | 0,9 |
| Айва | 0,6 |
| Алыча | 0,2 |
| Ананас | 0,4 |
| Бананы | 1,5 |
| Вишня | 0,8 |
| Гранат | 0,9 |
| Груша | 0,4 |
| Инжир | 0,7 |
| Кизил | 1 |
| Персики | 0,9 |
| Рябина | 1,4 |
| Черноплодная рябина | 1,5 |
| Слива | 0,8 |
| Хурма | 0,5 |
| Черешня | 1,1 |
| Шелковица | 0,7 |
| Яблоки | 0,4 |
| Яблоки зимние | 0,4 |
| Апельсин | 0,9 |
| Грейпфрут | 0,9 |
| Лимон | 0,9 |
| Мандарин | 0,8 |
| Брусника | 0,7 |
| Виноград | 0,6 |
| Голубика | 1 |
| Ежевика | 2 |
| Земляника | 0,8 |
| Клюква | 0,5 |
| Крыжовник | 0,7 |
| Малина | 0,8 |
| Морошка | 0,8 |
| Облепиха | 0,9 |
| Смородина белая | 0,3 |
| Смородина красная | 0,6 |
| Смородина чёрная | 1 |
| Черника | 1,1 |
| Шиповник свежий | 1,6 |
| Урюк | 5 |
| Курага | 5,2 |
| Изюм | 1,8 |
| Груша | 2,3 |
| Курага | 3 |
| Чернослив | 2,3 |
| Финики | 2,5 |
| Шиповник сухой | 3,4 |
| Яблоки | 3,2 |
| Зелёный горошек | 35 |
| Картофель | 6,6 |
| Картофельное пюре (хлопья) | 5,6 |
| Лук репчатый | 8,4 |
| Морковь | 7,8 |
| Свекла | 9 |
| Сельдерей (корень) | 7,8 |
| Баклажаны в томатном соусе | 1,8 |
| Зелёный горошек | 3,1 |
| Фасоль стручковая | 1,2 |
| Икра из баклажан | 1,7 |
| Икра из кабачков | 2 |
| Кукуруза целыми зернами | 2,2 |
| Оливки консервированные | 18 |
| Томаты с кожицей | 1,1 |
| Томатная паста | 4,8 |
| Томат-пюре | 3,6 |
| Шпинат-пюре | 2 |
| Соус томатный острый | 2,5 |
| Томатный сок | 1 |
| Свекольный сок | 1 |
| Морковный сок | 1,1 |
| Абрикосовый сок | 0,5 |
| Айвовый сок | 0,5 |
| Апельсиновый сок | 0,7 |
| Виноградный сок | 0,3 |
| Вишневий сок | 0,7 |
| Гранатовый сок | 0,3 |
| Грейпфрутовый сок | 0,3 |
| Лимонный сок | 0,6 |
| Мандариновый сок | 0,8 |
| Персиковый сок | 0,3 |
| Сливовый сок | 0,3 |
| Черносмородиновый сок | 0,5 |
| Шиповниковый сок | 0,1 |
| Яблочный сок | 0,5 |
| Компот из абрикосов | 0,5 |
| Компот из яблок | 0,2 |
| Яблоки в сиропе | 0,2 |
| Варенье из клубники | 0,3 |
| Варенье из малины | 0,6 |
| Варенье из сливы | 0,4 |
| Варенье из яблок | 0,4 |
| Джем из абрикосов | 0,4 |
| Джем из чёрной смородины | 0,6 |
| Повидло яблочное | 0,4 |
| Пюре яблочное | 0,6 |
| Паста яблочная с сахаром | 1 |
| Арахис | 26,3 |
| Арахис сушеный | 29,2 |
| Грецкие орехи | 15,6 |
| Миндаль сладкий | 18,6 |
| Подсолнечник (семена) | 20,7 |
| Фундук | 16,1 |
| Белые свежие | 3,7 |
| Белые сушеные | 20,1 |
| Лисички свежие | 1,6 |
| Маслята свежие | 2,4 |
| Опята свежие | 2,2 |
| Подосиновики свежие | 3,3 |
| Подосиновики сушеные | 35,4 |
| Рыжики свежие | 1,9 |
| Шампиньоны свежие | 4,3 |
| Бобы зелёные | 6 |
| Горошек зелёный | 5 |
| Фасоль (стручок) | 3 |
| Горох сухой | 20,5 |
| Горох лущенный | 23 |
| Соя | 34,9 |
| Фасоль | 21 |
| Чечевица | 24 |
| Пшеница мягкая озимая | 11,2 |
| Пшеница твёрдая | 13 |
| Рожь | 9,9 |
| Гречиха | 10,8 |
| Кукуруза сахарная | 11,2 |
| Кукуруза | 10,3 |
| Овес | 10 |
| Просо | 11,2 |
| Рис | 7,5 |
| Ячмень | 10,3 |
| Гречневая | 12,6 |
| Гречневая (продел) | 9,5 |
| Кукурузная | 8,3 |
| Овсяная | 11 |
| Геркулес | 11 |
| Толокно | 11,5 |
| Пшенная | 11,5 |
| Рисовая | 7 |
| Перловая | 9,3 |
| Ячменевая | 10 |
| Манная | 10,3 |
| Пшеничная "Полтавская" | 11,5 |
| Мука пшеничная, в/с | 10,3 |
| Мука пшеничная, 1 сорт | 10,6 |
| Мука пшеничная, 2 сорт | 11,7 |
| Мука пшеничная обойная | 11,5 |
| Мука ржаная сеяная | 6,9 |
| Мука ржаная обдирная | 8,9 |
| Мука ржаная обойная | 10,7 |
| Мука соевая | 36,5 |
| Мука соевая обезжиренная | 48,9 |
| Мука кукурузная | 7,2 |
| Мука ячменная | 10 |
| Макаронные изделия, в/с | 10,4 |
| Макароны молочные | 11,5 |
| Макароны яичные | 11,3 |
| Хлеб ржаной формовой | 6,6 |
| Хлеб ржано-пшеничный | 7 |
| Хлеб бородинский | 6,8 |
| Хлеб пеклеванный | 5,9 |
| Хлеб пшеничный зерновой | 8,1 |
| Хлеб пшеничный, 1 сорт | 7,6 |
| Хлеб паляница | 8,3 |
| Чебурек | 8 |
| Лаваш | 9,1 |
| Батон нарезной 1 сорт | 7,7 |
| Булка городская | 7,7 |
| Калач московский | 7,9 |
| Лепешка ржаная | 7,7 |
| Булочка сдобная | 7,9 |
| Сдоба выборгская с маком | 7,5 |
| Плюшка московская | 7,6 |
| Рожки обсыпные | 7,8 |
| Галеты из муки в/с | 9,7 |
| Крекеры из муки в/с | 9,2 |
| Печенье сахарное в/с | 7,5 |
| Печенье сдобное | 10,4 |
| Печенье миндальное | 7 |
| Пряники заварные | 4,8 |
| Баранки простые | 10,4 |
| Баранки сдобные | 8,3 |
| Бублики простые | 9 |
| Бублики с маком | 8,1 |
| Соломка сладкая | 9,7 |
| Сушки простые | 10,7 |
| Сушки горчичные | 9,2 |
| Сушки ванильные | 8,7 |
| Сухари армейские | 11,3 |
| Сухари дорожные | 10,9 |
| Сухари сливочные в/с | 8,5 |
| Агар пищевой | 4 |
| Агар из фурцеллярии | 4,8 |
| Дрожжи прессованные | 12,7 |
| Желатин пищевой | 87,2 |
| Отруби пшеничные | 15,1 |
| Какао-порошок | 24,2 |
| Какао тёртое | 13,5 |
| Крахмал картофельный | 0,1 |
| Крахмал кукурузный | 1 |
| Патока кукурузная | сл. |
| Пектин | |
| Порошок горчичный | 37,1 |
| Мёд натуральный | 0,8 |
| Сахар-сырец | 0 |
| Сахар-песок | 0 |
| Сахар-рафинад | 0 |
| Соль поваренная | 0 |
| Уксус 3%-ный | 0 |
| Батончики на кондитерском жире | 3,3 |
| Драже ореховое | 11,9 |
| Драже фруктовое в шоколаде | 3,7 |
| Ирис полутвердый | 3,3 |
| Карамель леденцовая | сл. |
| Карамель фруктовая | 0,1 |
| Карамель с ликёром | сл. |
| Карамель шоколадно-ореховая | 1,8 |
| Конфеты молочные | 2,7 |
| Конфеты помадные | 2,2 |
| Конфеты грильяжные | 5,3 |
| Конфеты кремовые | 7,5 |
| Конфеты фруктовые | 1,6 |
| Конфеты шоколадные | 4 |
| Зефир | 0,8 |
| Мармелад фруктово-ягодный | 0,4 |
| Пастила | 0,5 |
| Халва подсолнечная | 11,6 |
| Халва тахинная | 12,7 |
| Шоколад без добавлений | 5,4 |
| Шоколад молочный | 6,9 |
| Шоколад с орехами | 6,6 |
| Вафли с фруктовой начинкой | 3,2 |
| Вафли с жирной начинкой | 3,4 |
| Пирожное крошковое | 6,1 |
| Пирожное миндальное | 8,5 |
| Пирожное фруктовое | 5,1 |
| Пирожное слоёное с кремом | 5,4 |
| Пирожное трубочка с кремом | 5,9 |
| Торт с фруктовой начинкой | 4,7 |
| Торт слоёный с кремом | 5 |
| Молоко козье (сырое) | 3 |
| Молоко коровье (сырое) | 3,2 |
| Молоко коровье (стерил.) | 2,9 |
| Молоко коровье (паст.) | 2,8 |
| Молоко обезжиренное | 2 |
| Молоко топленое | 3 |
| Молоко сгущеное (с сахаром) | 7,2 |
| Какао со сгущ. молоком | 8,2 |
| Кофе со сгущ. молоком | 8,4 |
| Молоко сгущеное (стерил.) | 7 |
| Молоко сухое цельное | 26 |
| Сливки 10% жирности | 3 |
| Сливки 20% жирности | 2,8 |
| Сливки 35% жирности | 2,5 |
| Сливки взбитые плодовые | 2,8 |
| Сливки взбитые с шоколадом | 2,8 |
| Сливки сгущ. с сахаром | 8 |
| Сливки сухие | 23 |
| Сливки сухие высокожирные | 10 |
| Сметана 10% жирности | 3 |
| Сметана 20% жирности | 2,8 |
| Сметана 30% жирности | 2,4 |
| Сметана 40% жирности | 2,4 |
| Творог нежирный | 18 |
| Творог полужирный | 16,7 |
| Творог жирный | 14 |
| Творог мягкий диетический | 16 |
| Творожная масса сладкая | 11,3 |
| Сырки масса творожная | 7,1 |
| Сырки творожные детские | 9,1 |
| Сырки глазированные | 8,5 |
| Паста ацидофильная сладкая | 6,6 |
| Паста ацидофильная нежирная | 5,5 |
| Ацидофилин | 2,8 |
| Йогурт | 5 |
| Йогурт сладкий | 5 |
| Кефир жирный | 2,8 |
| Кефир нежирный | 3 |
| Кумыс из кобыльего молока | 2,05 |
| Кумыс из коровьего молока | 3 |
| Пахта пастеризованная | 3,3 |
| Пахта сквашенная | 3,3 |
| Простокваша | 2,8 |
| Простокваша Мечниковская | 2,8 |
| Ряженка 6% жирности | 3 |
| Сыворотка творожная | 0,8 |
| Сыворотка подсырная | 1 |
| Брынза из коровьего молока | 17,9 |
| Брынза из овечьего молока | 14,6 |
| Сыр "Вырусский" | 29 |
| Сыр "Голландский" | 26 |
| Сыр "Пошехонский" | 26 |
| Сыр "Прибалтийский" | 30 |
| Сыр "Российский" | 23 |
| Сыр "Рокфор" | 20 |
| Сыр плавленый "Российский" | 22 |
| Сыр колбасный копчёный | 23 |
| Мороженое молочное | 3,2 |
| Мороженое сливочное | 3,3 |
| Пломбир | 3,2 |
| Эскимо | 3,5 |
| Молочное шоколадное | 4,2 |
| Сливочное шоколадное | 3,5 |
| Пломбир шоколадный | 3,6 |
| Молочное крем-брюле | 3,5 |
| Сливочное крем-брюле | 3,5 |
| Пломбир крем-брюле | 3 |
| Молочное ореховое | 5,4 |
| Сливочное ореховое | 5,5 |
| Пломбир ореховый | 5,2 |
| Молочное клубничное | 3,8 |
| Сливочное клубничное | 3,8 |
| Мясо кролика | 21,1 |
| Мясо поросят | 20,6 |
| Телятина 1 категории | 19,7 |
| Баранина 1 категории | 15,6 |
| Баранья грудинка | 14 |
| Баранья корейка | 15,9 |
| Баранья тазобедренная часть | 17 |
| Буйволятина 1 категории | 19 |
| Верблюжатина 1 категории | 18,9 |
| Говядина 1 категории | 18,6 |
| Говяжья вырезка | 20,2 |
| Говяжья грудинка | 16,3 |
| Говяжья тазобедренная часть | 20,4 |
| Вымя говяжье | 12,3 |
| Печень говяжья | 17,9 |
| Почки говяжьи | 15,2 |
| Сердце говяжье | 16 |
| Язык говяжий | 16 |
| Оленина 1 категории | 19,5 |
| Свинина мясная | 14,3 |
| Свинина жирная | 11,7 |
| Свинина вырезка | 19,4 |
| Свинина грудинка | 8 |
| Свинина корейка | 13,7 |
| Свиная тазобедренная часть | 15 |
| Свиные ножки | 23,5 |
| Печень свиная | 18,8 |
| Язык свиной | 15,9 |
| Шпик свиной (без шкурки) | 1,4 |
| Шпик свиной солёный | 1,4 |
| Мясо яка | 20 |
| Колбаса вареная диабетическая | 12,1 |
| Колбаса вареная докторская | 12,8 |
| Колбаса вареная телячья | 13,8 |
| Колбаса вареная чайная | 11,7 |
| Колбаса в/копчёная любительская | 17,3 |
| Колбаса п/копчёная краковская | 16,2 |
| Колбаса п/копчёная украинская | 16,5 |
| Охотничьи колбаски п/копчёные | 25,7 |
| Колбаса сырокопченая зернистая | 9,9 |
| Колбаса сырокопченая сервелат | 24 |
| Ветчина особая | 17,6 |
| Мясной хлеб ветчинный | 12,9 |
| Ветчина из свинины в форме | 22,6 |
| Грудинка свиная копчено-запеченная | 10 |
| Грудинка свиная сырокопченая | 8,9 |
| Корейка свиная сырокопченая | 10,2 |
| Окорок свиной вареный | 14,3 |
| Сардельки говяжьи | 11,4 |
| Сардельки свиные | 10,1 |
| Сосиски любительские | 9 |
| Сосиски молочные | 11 |
| Говядина в собственном соку | 24,5 |
| Говядина тушеная | 16,8 |
| Завтрак туриста (говядина) | 20,5 |
| Колбасный фарш отдельный | 13,6 |
| Свинина тушеная | 14,9 |
| Фарш свиной сосисочный | 10,6 |
| Паштет мясной | 16,4 |
| Паштет печёночный | 11,6 |
| Пельмени мясные | 10,7 |
| Гуси 1 категории | 15,2 |
| Индейки 1 категории | 19,5 |
| Куры 1 категории | 18,2 |
| Перепёлки 1 категории | 18,2 |
| Утки 1 категории | 15,8 |
| Окорочек куриный | 21,3 |
| Филе куриное | 23,6 |
| Желудок куриный | 21 |
| Печень куриная | 20,4 |
| Сердце куриное | 15,8 |
| Яйцо куриное | 12,7 |
| Яйцо куриное (белок) | 11,1 |
| Яйцо куриное (желток) | 16,2 |
| Яйцо перепелиное | 11,9 |
| Яичный порошок | 46 |
| Колбаса вареная подмосковская | 17,2 |
| Курица в собственном соку | 23,2 |
| Фарш колбасный куриный | 13,9 |
| Вобла свежая | 18 |
| Вобла холодного копчения | 31,1 |
| Вобла каспийская вяленая | 46,4 |
| Горбуша | 21 |
| Горбуша солёная | 22,1 |
| Карп | 16 |
| Килька балтийская | 17,1 |
| Килька балтийская солёная | 17,1 |
| Килька горячего копчения | 21,3 |
| Лещ | 17,1 |
| Лещ морской | 21,3 |
| Лещ каспийский солёный | 25,2 |
| Лещ каспийский вяленый | 42 |
| Лещ горячего копчения | 32,8 |
| Лещ холодного копчения | 26,7 |
| Минтай | 15,9 |
| Мойва весенняя | 13,1 |
| Мойва осенняя | 13,6 |
| Окунь речной | 18,5 |
| Окунь морской свежий | 18,2 |
| Окунь морской гор. копчения | 23,5 |
| Окунь холодного копчения(балычок) | 26,4 |
| Осетр | 16,4 |
| Балык осетровый вяленый | 21,6 |
| Балык осетровый холодного копчения | 20,4 |
| Пикша | 17,2 |
| Сайра крупная | 18,6 |
| Сайра мелкая | 20,4 |
| Сельдь жирная свежая | 17,7 |
| Сельдь нежирная свежая | 19,1 |
| Сельдь атлантическая солёная | 17 |
| Скумбрия атлантическая | 18 |
| Снеток солено-сушеный | 46,3 |
| Ставрида океаническая | 18,5 |
| Ставрида хол. копчения | 17,1 |
| Судак | 18,4 |
| Треска | 16 |
| Треска солёная | 23,1 |
| Треска горячего копчения | 26 |
| Тунец | 24,4 |
| Угорь | 14,5 |
| Щука | 18,4 |
| Кальмар (мясо) | 18 |
| Краб камчатский (мясо) | 16 |
| Креветка (мясо) | 18,9 |
| Моллюск рапана | 16,7 |
| Мидии | 9,1 |
| Мясо ластоногих | 24,5 |
| Морская капуста | 0,9 |
| Икра горбуши зернистая | 31,2 |
| Икра кеты зернистая (красная) | 31,6 |
| Икра минтаевая пробойная | 28,4 |
| Икра осетровая зернистая | 28,9 |
| Икра осетровая паюсная | 36 |
| Килька пряного посола | 15,1 |
| Консервы "Морская капуста" | 1 |
| 560Консервы натуральные "креветки" | 17,8 |
| Консервы натуральные "крабы" | 18,7 |
| Консервы "Печень трески" | 4,2 |
| Консервы натуральные "Горбуша" | 20,9 |
| Консервы натуральные "Скумбрия" | 16,4 |
| Консервы "Ставрида в масле" | 15,6 |
| Консервы "Треска в масле" | 20,7 |
| Консервы в масле "Шпроты" | 17,4 |
| Консервы "Горбуша в томате" | 14,5 |
| Консервы "Ставрида в томате" | 14,8 |
| Консервы "Судак в томате" | 14 |
| Паста"Океан" | 13,6 |
| Масло крестьянское несолёное | 0,8 |
| Масло крестьянское солёное | |
| Масло сливочное несолёное | 0,5 |
| Масло бутербродное | 2,5 |
| Масло топленое | 0,3 |
| Масло кукурузное | 0 |
| Масло кунжутное | 0 |
| Масло оливковое | 0 |
| Масло подсолнечное | 0 |
| Масло соевое | 0 |
| Майонез "Провансаль" | 3,1 |
| Майонез столовый молочный | 2,4 |
| Маргарин столовый молочный | 0,3 |
| Маргарин "Экстра" | 0,5 |
| Жир кулинарный "Прима" | 0 |
| Жир кондитерский | 0 |
| Жир бараний топленый | 0 |
| Жир свиной топленый | 0 |
| Жир говяжий топленый | 0 |
| Жир тресковый | 0 |
| Лимонад цитрусовый | |
| Лимонад плодовоягодный | |
| Пиво жигулевское 2,8% об. | 0,6 |
| Пиво "Портер" 5%об. | 1,1 |
| Квас хлебный 0,8% об. | 0,2 |
| Вино столовое белое 11% об. | 0,2 |
| Вино столовое красное 12% об. | 0,3 |
| Вино десертное белое 16% об. | 0,5 |
| Шампанское полусухое 12%об. | 0,2 |
| Водка 40%об. | 0 |
| Коньяк "3 звёздочки" 40%об. | 0 |
| Настойка "Старка" 43%об. | 0 |
| Наливка "Сливянка" 18%об. | 0 |
| Ликёр "Вишнёвый" 25%об | 0 |
| Пунш "Чёрносмородиновый"17%об | 0 |
| Чай черный байховый | 20 |
| Кофе жареный в зернах | 13,9 |
| Кофе растворимый | 15 |
www.pravilnoe-pokhudenie.ru
Классификация белков.
I. Таблица 2. Классификация белков по их структуре.
| Класс белков | Характеристика | Функция |
| Фибриллярные | Наиболее важна вторичная структура (третичная почти не выражена) Нерастворимы в воде Отличаются большой механической прочностью Длнные параллельные полипептидные цепи, скрепленные друг с другом поперечными сшивками, образуют длинные волокна или слоистые структуры | Выплняют структурные функции. К этой группе относятся, например, коллаген (сухожилия, кости, соединительная ткань), миозин (мышцы), фиброин (шелк, паутина), кератин (волосы, рога, ногти, перья). |
| Глобулярные | Наиболее важна третичная структура Полипептидные цепи сверуты в компактные глобулы Растворимы | Выполняют функци ферментов, антител, и в некоторых случаях гормонов (например, инсулин), а также ряд другихважных функций |
| Промежуточные | Фибриллярной природы , но растворимы | Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови |
II. Классификация белков по их составу.
Белки
Простые Сложные
Состаят только из аминокислот Состоят из глобулярных белков и небелкового
материала. Небелклвую часть называют
простетической группой.
Таблица 3. Сложные белки.
| Название | Простетическая группа | Пример |
| Фосфопротеины | Фосфорная кислота | Казеин молока Вителлин яичного желтка |
| Гликопротеины | Углевод | Компоненты мембран Муцин (компонент слюны) |
| Нуклеопротеины | Нуклеиновая кислота | Компоненты вирусов Хромосомы Рибосомы |
| Хромопротеины | Пигмент | Гемоглобин – гем (железосодержащий пигмент) Фитохром (пигмент ратительного происхождения) Цитохром (дыхательный пигмент) |
| Липопротеины | Липид | Компоненты мембран Липопротеины крови – транспортная форма липидов |
| Металлопротеины | Металл | Нитраредуктаза – фермент, катализирующий в растенияхпревращение натрата в нитрит |
III. Таблица 4. Классификация белков по функциям.
| Класс белков | Примеры | Локализация/функция |
| Структурные белки | Коллаген Кератин Эластин | Компонент соединительной ькани, костей, сухожилий, хряща Кожа, перья, ногти, волосы, рога Связки |
| Ферменты | Трипсин Рибулозобифосфат-карбоксилаза | Катализирует гидролиз белков Катализирует (присоединение СО2) при фотосинтезе |
| Гормоны | Инсулин Глюкагон АКТГ | Регулируют обмен глюкозы Стимулирует рост и активность коры надпоченков |
| Дыхательные пигменты | Гемоглобин Миоглобин | Переносит О2 в крови позвоночных Служит для запасания О2 в мышцах |
| Транспортные белки | Альбумин | Служит для транспорта жирных кислот и липидов в крови |
| Защитные белки | Антитела Фибриноген Тромбин | Образуют комплексы с чужеродными белками Предшественник фибрина при свертывании крови Участвует в процессе свертывания крови |
| Сократительные белки | миозин Актин | Подвижные нити мышц Неподвижные нити мышц |
| Запасные белки | Яичный альбумин Казеин | Белок яйца Белок молока |
| Токсины | Змеиный яд | Ферменты |
Ферменты (энзимы) – специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Ферменты ускоряют реакции без изменений ее общего результата.
Ферменты высокоспецифичны: каждый фермент катализирует определенный тип химических реакций в клетках. Этим обеспечивается тонкая регуляция всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и др.)
Пример: фермент уреаза катализирует расщепление лишь мочевины, не оказывая каталитического давления на структурно родственные соединения.
Активность ферментов ограничена довольно узкими температурными рамками (35-45°С), за пределами которых активность падает и исчезает. Ферменты активны при физиологических значениях Ph, т.е. в слабощелочной среде.
По пространственной организации ферменты состоят из нескольких доменов и обычно обладают четвертичной структурой.
Ферменты могут иметь в своем составе и небелковые компоненты. Белковая часть называется апофермент, а небелковая – кофактор (если это простое неорганическое вещество, например Zn2+, Mg2+) или кофермент (коэнзим) (если речь идет об органических соединениях).
Предшественниками многих коферментов являются витамины.
Пример: пантатеновая кислота – предшественник коэнзима А, играющего важную роль в метаболизме.
В молекулах ферментов имеется так называемый активный центр. Он состоит из двух участков – сорбционного и каталитического. Первый отвечает за связывание ферментов с молекулами субстрата, а второй – за протекание собственно акта катализа.
В название ферментов присутствует название субстрата, на который воздействует данный фермент, и окончание « - аза».
Пример:
ü целлюлоза – катализирует гидролиз целлюлозы до моносахаридов.
ü протеаза – гидролизирует белки до аминокислот.
По этому принципу все ферменты разделены на 6 классов.
Оксидоредуктазы катализируют окислительно-восстановительные реакции, осуществляя перенос атомов Н и О и электронов от одного вещества к другому, окисляя при этом первый и восстанавливая второй. Эта группа ферментов участвует во всех процессах биологического окисления.
Пример: в дыхании
АН + В ↔А +ВН (окислительный)
А + О ↔ АО (восстановительный)
Трансферазы катализируют перенос группы атомов (метильной, ацильной, фосфатной и аминогруппы) от одного вещества к другому.
Пример: под давлением фосфотрансфераз происходит перенос остатков фосфорной кислоты от АТФ на глюкозу и фруктозу: АТФ + глюкоза ↔ глюкоза – 6 – фосфат + АДФ.
Гидролазы ускоряют реакции расщепляют сложных органических соединений на более простые путем присоединения молекул воды в месте разрыва химических связей. Подобное расщепление называется гидролизом.
Сюда относятся амилаза (гидролизирует крахмал), липаза (расщепляет жиры) и др.:
АВ + Н2О↔АОН + ВН
Лиазы катализируют негидролитические присоединения к субстрату и отщепление от него группы атомов. При этом может быть разрыв связи С – С, С – N, C – O, C – S.
Пример: отщепление карбоксильной группы декарбоксилазой
O O
// //
Ch4 – C – C ↔ CO2 + Ch4 – C
׀׀ \ \
O OH H
Изомеразыосуществляют внутримолекулярные перестройки, т.е. катализируют превращение одного изомера в другой:
глюкоза – 6 – фофсат ↔ глюкоза – 1 – фосфат
Липазы (синтетазы) катализируют реакции соединения двух молекул с образованием новых связей С – О, С – S, P – N, C – C, используюя энергию АТФ.
К липазам относится группа ферментов, катализирующих присоединение остатков аминокислот т-РНК. Эти синтетазы играют важную роль в процессе синтеза белка.
Пример: фермент валин – т-РНК – синтетаза под его действием образуется комплекс валин-т-РНК:
АТФ + валин + тРНК↔ АДФ+Н3РО4+валин-тРНК
Похожие статьи:
poznayka.org
2. 1. Общая характеристика белков.
Лекция 2. Химия белков.
Белки – это высокомолекулярные органические, азотсодержащие соединения, состоящие из аминокислот.
Белки – наиболее сложные соединения живых систем. Не только каждый вид живого, но и каждый орган, каждый тип клеток обладает своим специфическим набором белков. Наконец, каждый индивидуум отличается от подобных своего вида собственным набором белков (биохимическая индивидуальность). Эта индивидуальность поддерживается всеми живущими организмами. При внедрении в организм чужих белков образуются защитные вещества (антитела) и разрушают чужие белки. Однако имеется и общность между определенными белками одного и того же вида, которая позволяет проводить обмен белками (например, переливание крови).
В количественном отношении они занимают первое место среди всех содержащихся в живой клетке макромолекул. В организме человека белки составляют примерно 1/5 часть, или 20 % массы, а в пересчете на сухой вес - 45%. Содержание белков в разных тканях различно, так в мышцах и печени содержится до 22 % белка, в мозге – 11 %, в жировой ткани – 6 %.
Свое название белки получили от белого цвета куриного яйца, на примере которого изучались их свойства. В 1838 г. Н. Мульдер назвал белки протеинами (от греч. protos - первый, важный). Это же название принято в международной номенклатуре.
Белки занимают первое место среди макромолекул не случайно, ведь там где есть белки, отмечены признаки жизни и наоборот там где есть жизнь, обнаруживаются белки.
2. 2 Функции белков в организме.
Белки, входящие в состав организма человека, отличаются большим
разнообразием состава, структуры, местом расположения и соответственно функциями.
Белки выполняют следующие функции в организме:
Каталитическая или ферментативная функция. Одна из основных функций белков. В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами и ускоряют все биохимические процессы в организме. Практически все они являются по своей химической природе белками.
Структурная или пластическая функция. Еще одна из важнейших функций белков. Мембраны всех клеток и субклеточных единиц представляют собой бислой: белки и фосфолипиды, т.е. белки играют большую роль в формировании всех клеточных структур. Эту функцию выполняют, например следующие белки: кератин – составляет основу волос и ногтей, коллаген – главный белок соединительной ткани.
Сократительная функция. Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят и изменение форм клеток и субклеточных частиц.
Транспортная функция. Перенос различных веществ по крови и в пределах клетки. Например, альбумины переносят по крови ВЖК, лекарственные вещества, билирубин; гемоглобин переносит кислород и углекислый газ, другие белки транспортируют липиды, стероиды, витамины и т.д.
Защитная функция. В процессе эволюции в организме выработан механизм узнавания и связывания «чужих» молекул с помощью белков-антител, которые являются белковой фракцией гамма-глобулинов; кроме этого ряд белков, например, альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови; белки свертывающей (фибриноген, протромбин и др.) и противосвертывающей системы предотвращают свертывание крови в нормальных условиях и наоборот образуют сгустки крови при повреждениях сосудов.
Регуляторная функция. Среди молекул-регуляторов важное место принадлежит регуляторам белковой природы, таким как гормоны, 50% которых имеют белковую природу; белки-гистоны, кислые белки играют роль в регуляции процесса трансляции в биосинтезе белка; белки крови альбумины играют большую роль в создании и поддержании онкотического и осмотического давления крови; белки входя в состав белковой и гемоглобиновой буферных систем участвуют в поддержании рН крови и т.д.
Рецепторная функция. Избирательное связывание различных регуляторов-гормонов, биогенных аминов, простогландинов, медиаторов, циклических мононуклеотидов, протекает с помощью белков-рецепторов на мембранах клетки.
Опорная или механическая функция. Прочность соединительной, хрящевой и костной ткани за счет белков – коллагена, эластина, фибронектина.
Энергетическая функция. 1 г. белка, окисляясь до конечных продуктов – мочевины, углекислого газа и воды, дает 4,1 ккал энергии.
studfiles.net
Защитная функция белков. Строение и функции белков
Белки являются основой всех живых организмов. Именно эти вещества выступают компонентом клеточных мембран, органелл, хрящей, сухожилий и роговых производных кожи. Однако защитная функция белков - одна из самых важных.
Белки: особенности строения
Наряду с липидами, углеводами и нуклеиновыми кислотами белки являются органическими веществами, составляющими основу живых существ. Все они - природные биополимеры. Эти вещества состоят из многократно повторяющихся структурных единиц. Они называются мономеры. Для белков такими структурными единицами являются аминокислоты. Соединяясь в цепочки, они образуют крупную макромолекулу.

Уровни пространственной организации белка
Цепочка, состоящая из двадцати аминокислот, может образовывать различные структуры. Это уровни пространственной организации или конформации белка. Первичная структура представлена цепью из аминокислот. Когда она закручивается в спираль, возникает вторичная. Третичная структура возникает при закручивании предыдущей конформации в клубок или глобулу. А вот следующая структура самая сложная - четвертичная. Она состоит из нескольких глобул.
Свойства белков
Если четвертичная структура разрушается до первичной, а именно до цепи аминокислот, то происходит процесс, который называется денатурацией. Он обратим. Цепочка аминокислот способна снова образовать более сложные структуры. А вот когда происходит деструкция, т.е. разрушение первичной структуры, белок восстановить уже невозможно. Такой процесс является необратимым. Деструкцию осуществлял каждый из нас, когда термически обрабатывал продукты, состоящие из белка - куриные яйца, рыбу, мясо.

Функции белков: таблица
Белковые молекулы очень многобразны. Это обусловливает широкий спектр их возможностей, которые обусловлены строением аминокислот. Функции белков (таблица содержит необходимую информацию) являются необходимым условием существования живых организмов.
| Функция белка | Значение и суть процесса | Название белков, осуществляющих функцию |
Строительная (структурная) | Белок является строительным материалом для всех структур организма: от мембран клетки до мышц и связок. | Коллаген, фиброин |
| Энергетическая | При расщеплении белков выделяется энергия, необходимая для осуществления процессов жизнедеятельности организма (1 г белка - 17, 2 кДж энергии). | Проламин |
| Сигнальная | Белковые соединения клеточных мембран способны распознавать специфические вещества из окружающей среды. | Гликопротеиды |
| Сократительная | Обеспечение двигательной активности. | Актин, миозин |
| Резервная | Запас питательных веществ. | Эндосперм семян |
| Транспортная | Обеспечение газообмена. | Гемоглобин |
| Регуляторная | Регуляция химических и физиологических процессов в организме. | Белки гормонов |
| Каталитическая | Ускорение протекания химических реакций. | Ферменты (энзимы) |
Защитная функция белков в организме
Как видите, функции белков очень разнообразны и важны по своему значению. Но мы не упомянули еще об одной из них. Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами.

Процесс формирования иммунитета
С каждым вздохом в наш организм проникают болезнетворные бактерии и вирусы. Они попадают в кровь, где начинают активно размножаться. Однако на их пути встает значительная преграда. Это белки плазмы крови - иммуноглобулины или антитела. Они являются специализированными и характеризуются способностью распознавать и обезвреживать чужеродные для организма вещества и структуры. Они называются антигенами. Так проявляется защитная функция белков. Примеры ее можно продолжить информацией об интерфероне. Этот белок также является специализированным и распознает вирусы. Это вещество даже является основой многих иммуностимулирующих лекарственных препаратов.
Благодаря наличию защитных белков организм способен противостоять болезнетворным частицам, т.е. у него формируется иммунитет. Он может быть врожденным и приобретенным. Первым все организмы наделены еще с момента появления на свет, благодаря чему и возможна жизнь. А приобретенный появляется после перенесения различных инфекционных заболеваний.
Механическая защита
Белки выполняют защитную функцию, непосредственно предохраняя клетки и весь организм от механических воздействий. К примеру, наружный скелет ракообразных играет роль панциря, надежно защищая все содержимое. Кости, мышцы и хрящи образуют основу организма, и не только предотвращают повреждение мягких тканей и органов, но и обеспечивают его передвижение в пространстве.

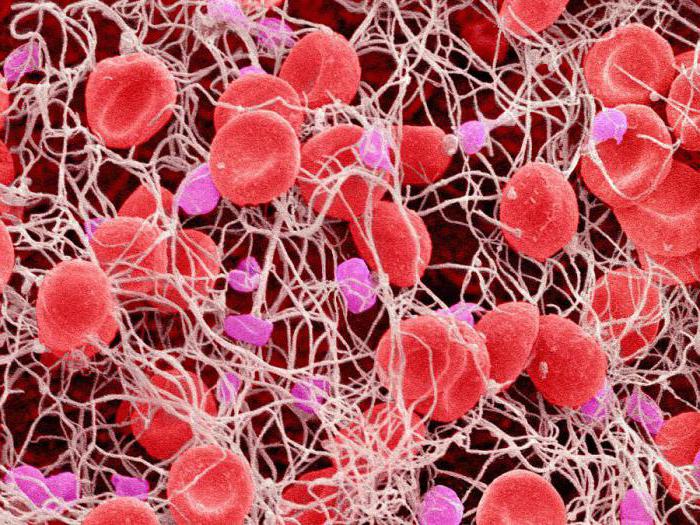
Образование тромбов
Процесс свертывания крови - это также защитная функция белков. Он возможен благодаря наличию специализированных клеток - тромбоцитов. При повреждении кровеносных сосудов они разрушаются. В результате растворимый белок плазмы фибриноген превращается в его нерастворимую форму - фибрин. Это сложный ферментативный процесс, в результате которого нити фибрина очень часто переплетаются и образуют густую сеть, которая препятствует вытеканию крови. Другими словами, образуется сгусток крови или тромб. Это является защитной реакцией организма. При нормальной жизнедеятельности этот процесс длится максимум до десяти минут. Но при болезни несвертываемости крови - гемофилии, которой страдают в основном мужчины, человек может погибнуть даже при незначительном ранении.
Однако если тромбы образуются внутри кровеносного сосуда, это может быть очень опасно. В некоторых случаях это даже приводит к нарушению его целостности и внутреннему кровоизлиянию. В этом случае рекомендованы препараты, наоборот, разжижающие кровь.
Химическая защита
Защитная функция белков проявляется и в химической борьбе с болезнетворными веществами. И начинается она уже в ротовой полости. Попадая в нее, пища вызывает рефлекторное выделение слюны. Основу этого вещества составляет вода, ферменты, которые расщепляют полисахариды и лизоцим. Именно последнее вещество обезвреживает вредоносные молекулы, защищая организм от их дальнейшего воздействия. Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Итак, защитная функция белков проявляется в первую очередь в обезвреживании бактериальных и вирусных частиц в крови организма. В результате у него формируется способность противостоять болезнетворным агентам. Ее и называют иммунитетом. Белки, которые входят в состав наружного и внутреннего скелета, защищают внутреннее содержимое от механических повреждений. А белковые вещества, находящиеся в слюне и других средах, предотвращают действие на организм химических агентов. Другими словами, защитная функция белков заключается в обеспечении необходимых условий для всех процессов жизнедеятельности.
fb.ru
Белок в пищевых продуктах. Таблица белков в продуктах питания
Белки наравне с жирами и углеводами составляют наше питание. Все они равноценны по важности для организма.  В данной статье мы рассмотрим, что собой представляет белок, сформируем список белков в продуктах растительного и животного происхождения, укажем ориентировочную потребность человека в соответствии с его полом, возрастом и видом деятельности.
В данной статье мы рассмотрим, что собой представляет белок, сформируем список белков в продуктах растительного и животного происхождения, укажем ориентировочную потребность человека в соответствии с его полом, возрастом и видом деятельности.
Что такое белок?
Научное название белка - протеин, что в переводе с греческого означает "первый". Высокомолекулярное вещество органического происхождения состоит из аминокислот. Белок входит в состав всех, абсолютно всех клеток организма. Большая часть клеток состоит из него наполовину.
В человеческом организме 21 аминокислота, из них 8 являются незаменимыми для полноценного функционирования. Это:
- лейцин;
- лизин;
- валин;
- триптофан;
- метионин;
- треонин;
- изолейцин;
- фенилалалин.
 Незаменимость означает, что организм не имеет возможности производить его самостоятельно и, следовательно, должен получать из внешних источников. В помощь вам - таблица белков в продуктах питания, которая будет указана ниже.
Незаменимость означает, что организм не имеет возможности производить его самостоятельно и, следовательно, должен получать из внешних источников. В помощь вам - таблица белков в продуктах питания, которая будет указана ниже.
Функция белка в организме
Итак, визуально для вас протеин - это:
- мыщцы;
- кожа;
- органы;
- волосы.
А если рассматривать глобально, то белок обеспечивает вам полноценное существование, так как:
- Защищает от вирусов. Большое количество белков в продуктах, которые вы включаете в свой рацион, - это иммунитет, так как именно из протеина состоят антитела, которые противостоят инфекциям.
- Регулирует все процессы в организме. Белки - исходное сырье для всевозможных элементов, которые обеспечивают человеку комфортное существование. К примеру, это желудочный сок, гемоглобин.
- Строит. Весь тот перечень, что мы указали выше (волосы, мышцы и т. д.), - это протеин, а точнее миозин и актин.
- Передает. Гемоглобин - протеин а-ля "общественный транспорт", так как именно он переносит углекислый газ с кислородом. О важности этого процесса отдельно рассказывать нет смысла, так как он всем знаком.
- Питает. 1 грамм белка - это 4 ккал. Хотя в основном энергию организм получает из углеводов и жиров, а белок в пищевых продуктах идет на прочие нужды, но при необходимости он может сыграть и первую скрипку.

Потребность человека в белке
После всего сказанного о белке может сложиться впечатление, что чем больше, тем лучше. А почему бы не дать организму столько полезного, если есть возможность? Однако это ошибочное мнение. Лучшее - враг хорошего. Для человека нет ничего полезнее баланса, вне зависимости от области применения. В связи с этим выведена формула, по которой вычисляется оптимальное количество белка для человека в соответствии с его жизнью и весом. Так, усредненное количество - 0,85 грамма белка на каждый килограмм веса. Это количество покрывает суточную потребность в протеине. Количество белков в продуктах (таблица ниже) поможет грамотно составить рацион.
А теперь - детали. Если вы ведете активный образ жизни, то количество белка необходимо повысить до 1,7 грамм на каждый килограмм веса. При такой пропорции повышается синтез белка в мышцах. Если обратиться к показателям спортсменов, то данные следующие:
- для развития или поддержания имеющейся мышечной массы нужно потреблять около 1,5 грамма белка на килограмм веса;
- для снижения процента жира в организме можно временно повысить потребление до 1,9 грамма белка на килограмм веса.
Для гармоничного и оптимального усваивания белка рекомендуется не превышать его потребление выше 30 грамм за один прием пищи.

Таблица белков в продуктах питания животного происхождения
Животные белки по сравнению со своими растительными собратьями имеют более совершенный состав тех самых незаменимых аминокислот. Рассмотрим перечень богатых белком продуктов животного происхождения.
| Продукты | Количество белка на 100 грамм, граммы |
| Яйцо куриное | 12,8 |
| Порошок яичный | 44,8 |
| Сыворотка молочная | 3 |
| Молоко средней жирности | 2,9 |
| Кефир средней жирности | 2,7 |
| Творог обезжиренный | 18 |
| Творог 5%-й жирности | 10,1 |
| Творог 9%-й жирности | 9,7 |
| Сыр "Российский" | 25 |
| Сыр "Пармезан" | 36 |
| Говядина | 19 |
| Нежирная свинина | 16,5 |
| Красная рыба (горбуша) | 20,9 |
| Куриное филе | 22 |
| Печень говяжья | 17,5 |
| Сердце | 15 |
| Филе индейки | 21,4 |
| Мясо кролика | 21 |
| Телятина | 19,8 |
| Колбаса вареная | 14 |
| Колбаса сырокопченая | 15,7 |
| Креветки | 27 |
| Тунец | 23 |
| Семга | 21 |
| Кальмар | 18 |
| Хек | 17 |
| Сельдь | 16,4 |
| Язык | 15,8 |
| Сливки жирные, сметана | 2,8 |
Таблица белков в продуктах питания растительного происхождения
Вегетарианцам сложнее набирать необходимую норму продуктов для обеспечения организма необходимыми аминокислотами, в большинстве случаев им приходится прибегать к специальным пищевым добавкам.  Рассмотрим перечень богатых белком продуктов растительного происхождения.
Рассмотрим перечень богатых белком продуктов растительного происхождения.
| Продукты | Количество белка на 100 грамм, граммы |
| Сухой горох | 21,9 |
| Фасоль | 23,8 |
| Соевые бобы | 26,1 |
| Чечевица | 28 |
| Мука пшеничная высшего сорта | 10,8 |
| Мука ржаная | 10,7 |
| Овсяная крупа | 11,2 |
| Гречневая крупа | 13,2 |
| Рис | 6,9 |
| Пшено | 12,4 |
| Манная крупа | 12 |
| Перловая крупа | 8,7 |
| Ячменная крупа | 9,8 |
| Арахис | 26,4 |
| Кукуруза | 8,5 |
| Картофель | 2 |
| Баклажаны | 1,1 |
| Цветная капуста | 2,6 |
| Капуста краснокочанная | 0,6 |
| Квашеная капуста | 1,9 |
| Лук репчатый | 1,5 |
| Лук зеленый | 1,4 |
| Морковь | 1,3 |
| Шпинат | 2,9 |
| Салат зеленый | 1,6 |
| Свекла | 1,6 |
| Редька | 1,9 |
| Изюм | 1,8 |
| Миндаль | 58 |
В идеале нужно сочетать в рационе белки как животного, так и растительного происхождения, так как последние - источник клетчатки и витаминов. Плюс растительный белок легче переваривается и не несет с собой в довесок жир и холестерин, в отличие от животного собрата. Таблица белков в продуктах питания поможет соблюсти баланс.
Дефицит протеина и его последствия
Для того чтобы представить последствия систематического недобора белка, достаточно просто еще раз прочитать все его основные функции в организме и мыслить от противного. Иными словами, дефицит белка - это:
- ослабленный иммунитет;
- сбой процессов, обеспечивающих комфортную жизнедеятельность организма;
- проблемы с мышцами, кожей, волосами, общее истощение;
- анемия.
Профицит белка и его последствия
Все хорошо в меру, всем это известно. В погоне за мышечной массой, красивым рельефом и развитой фигурой многие спортсмены склонны переедать белок. Также это касается тех, кто увлекается диетами с низким содержанием углеводов и набирает основное количество суточной нормы калорий белками и жирами. Необходимо помнить, что таблица белка в продуктах позволит вам придерживаться нормы.
- Систематическое превышение нормы белка чревато развитием камней в почках. Риск повышается в 2,5 раза!
- Избыток белка способен стимулировать развитие такого заболевания, как остеопороз. Если у вас проблемы с почками, даже незначительные, ударная доза белка их усугубит.
- Обезвоживание. Да, действительно, не самая страшная проблема на фоне прочих, достаточно просто потреблять необходимое количество жидкости.
- Избыток белка повышает риск онкологических заболеваний пищеварительной системы.
- При дисбалансе в питании с превышением нормы белков может развиться кетоз. Этот процесс характеризуется ростом кетоновых тел (продукт расщепления жировых клеток). Избыток кетонов отравляет организм, вызывая тошноту, приступы рвоты и запах ацетона от организма. В крайних случаях подобное состояние может повлечь за собой кетоацитозную кому, что является прямой угрозой для жизни. Чтобы этого избежать, корректируйте свой рацион с умом (таблица белка в продуктах поможет в этом).
Пищевые добавки, богатые протеином
Как быть, если предписанную норму белков не получается добрать обычными продуктами питания? Тут на помощь приходят специальные пищевые добавки. Не стоит пугаться - это касается в первую очередь спортсменов, так как среднестатистический человек без проблем "съест" свои 0,85 грамма на 1 килограмм веса. Не стоит пугаться, это не продукты питания, не стероиды и прочие страшилки, это чистый белок. Естественно, необходимо со всей ответственностью подойти к выбору - не только количество белков в продуктах (таблица - выше), но и отзывы из серьезных источников должны лечь за основу. Так, например, стоит отдельно отметить столь популярную нынче добавку ВСАА - это тот же белок, который уже расщепили за вас, оставив три незаменимые аминокислоты, из которых мыщцы состоят примерно на 30 %. Эта добавка показана при интенсивных физических нагрузках, так как она стимулирует быстрое восстановление мышц.
Итог
Что еще можно сказать? Белок - это один из трех китов, на которых держится здоровье человека.  Состав белков в продуктах крайне важен в процессе построения здорового рациона. Нет необходимости фанатично следить за предписанными граммами протеина на килограмм веса - его количество изо дня в день может колебаться в соответствии с вашими предпочтениями, но средние показатели должны соответствовать норме.
Состав белков в продуктах крайне важен в процессе построения здорового рациона. Нет необходимости фанатично следить за предписанными граммами протеина на килограмм веса - его количество изо дня в день может колебаться в соответствии с вашими предпочтениями, но средние показатели должны соответствовать норме.
fb.ru
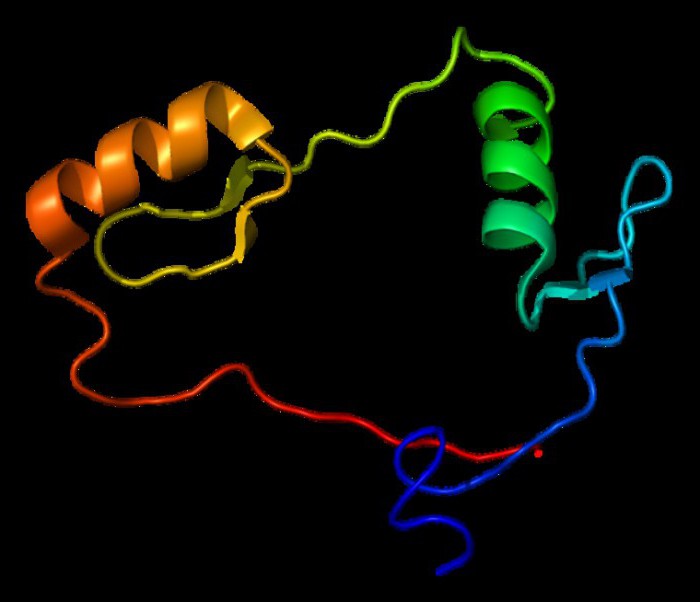
Уровни структурной организации белковой молекулы. Функции белков.
Принято выделять четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная и четвертичная структура. Рассмотрим особенности каждого из этих уровней.
2.1.1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. 1.4.2). Имейте в виду, что даже небольшие изменения первичной структуры белка могут значительно изменять его свойства. Примером заболеваний, развивающихся в результате изменения первичной структуры белка, являются гемоглобинопатии (гемоглобинозы) .
В эритроцитах здоровых взрослых людей присутствует гемоглобин А (Hb А) . В крови некоторых людей содержится аномальный (изменённый) гемоглобин - гемоглобин (Hb S). Единственное отличие первичной структуры Hb S от Hb A - замена гидрофильного остатка глутаминовой кислоты на гидрофобный остаток валина в концевом участке их β-цепей:

Как известно, основная функция гемоглобина -транспорт кислорода к тканям. В условиях пониженного парциального давления О2 снижается растворимость гемоглобина S в воде и его способность связывать и переносить кислород. Эритроциты принимают при этом серповидную форму, быстро разрушаются, вследствие чего развивается малокровие (серповидно-клеточная анемия] .
Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белка. Установлено, что каждой полипептидной последовательности соответствует только один стабильный вариант пространственной структуры. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг.
До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, без участия каких-либо компонентов. Однако сравнительно недавно обнаружилось, что это справедливо только для сравнительно небольших белков (порядка 100 аминокислотных остатков). В процессе фолдинга более крупных белков принимают участие специальные протеины - шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка.
2.1.2. Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО-и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α-спираль и β-складчатый слой.
α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм (рисунок 2.1).

Рисунок 2.1. α-Спираль.
Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль.
β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.

Рисунок 2.2. β-Складчатый слой.
Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации.
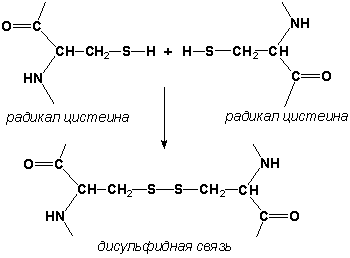
2.1.3. Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
- Водородные связи образуются между двумя полярными незаряженными радикалами или между незаряженным и заряженным радикалами, например, радикалами серина и глутамина:
- Ионные связи могут возникать между противоположно заряженными радикаламинапример, радикалами глутамата и аргинина:
- Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина:
- Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи:.



По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
- Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
- Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
- Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся:
- Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
- Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
- Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
2.1.4. Четвертичная структура белка - размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка.Четвертичная структура - высший уровень организации белковой молекулы, к тому же необязательный - более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, - субъединицами или протомерами. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями разных типов.
Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем объединяется с другими путём самосборки. Каждая субъединица содержит участки, способные взаимодействовать с соответствующими участками других субъединиц. Эти взаимодействия осуществляются посредством водородных, ионных и гидрофобных связей между радикалами аминокислот, входящих в состав разных цепей.
Олигомерные белки могут существовать в виде нескольких устойчивых конформаций и обладают аллостерическими свойствами, то есть способны переходить из одной конформаций в другую с изменением своей функциональной активности. Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент фосфофруктокиназа и многие другие.
Более подробно структурная организация и функционирование олигомерных белков будут рассмотрены в следующей теме на примере гемоглобина (рисунок 2.3).

Рисунок 2.3. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом.
Известны также белки, модекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (инсулин, тромбин). Подобные белки нельзя олигомерными. Такие белки образуются из единой полипептидной цепи в результате частичного протеолиза - локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают.
dendrit.ru












