Значение словосочетания «сложные белки». Сложный белок
определение, состав, строение, структура, функции, классификация и характеристика. Чем отличаются простые белки от сложных?
Образование 1 июля 2016Сложный белок, кроме собственно белкового компонента, содержит дополнительную группу иной природы (простетическую). В качестве данного компонента выступают углеводы, липиды, металлы, остатки фосфорной кислоты, нуклеиновые кислоты. Чем отличаются простые белки от сложных, на какие виды подразделяют эти вещества, и каковы их особенности, расскажет эта статья. Главное отличие рассматриваемых веществ – их состав.
Сложные белки: определение
Это двухкомпонентные вещества, в состав которых входит простой белок (пептидные цепи) и небелковое вещество (простетическая группа). В процессе их гидролиза образуются аминокислоты, небелковая часть и продукты распада. Чем отличаются простые белки от сложных? Первые состоят только из аминокислот.
Классификация и характеристика сложных белков
Эти вещества делятся на виды в зависимости от типа дополнительной группы. К сложным белкам относятся:
- Гликопротеины – белки, молекулы которых содержат углеводный остаток. Среди них выделяют протеогликаны (компоненты межклеточного пространства), включающие в свою структуру мукополисахариды. К гликопротеидам относятся иммуноглобулины.
- Липопротеиды включают липидный компонент. К ним относятся аполипопротеины, выполняющие функцию обеспечения липидного транспорта.
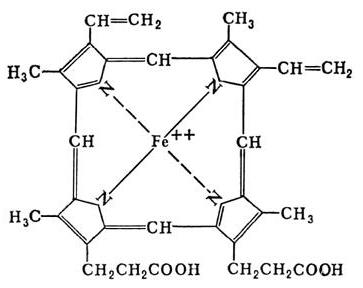
- Металлопротеины содержат ионы металлов (меди, марганца, железа и др.), связанные через донорно-акцепторное взаимодействие. В эту группу не входят гемовые белки, включающие соединения профиринового кольца с железом и подобные им по структуре соединения (хлорофилл, в частности).
- Нуклеопротеиды – белки, имеющие нековалентные связи с нуклеиновыми кислотами (ДНК, РНК). К ним относится хроматин – компонент хромосом.
- 5. Фосфопротеиды, к которым относится казеин (сложный белок творога), включают ковалентно соединенные остатки фосфорной кислоты.
- Хромопротеины объединяет окрашенность простетического компонента. Данный класс включает гемовые белки, хлорофиллы и флавопротеиды.
Видео по теме
Особенности гликопротеинов и протеогликанов
Эти белки являются сложными веществами. Протеогликаны содержат большую долю углеводов (80-85%), у обычных гликопротеидов содержание составляет 15-20%. Уроновые кислоты присутствуют только в молекуле протеогликанов, их углеводы отличаются регулярным строением с повторяющимися звеньями. Какова структура и функции сложных белков гликопротеинов? Их углеводные цепи включают только 15 звеньев и имеют нерегулярное строение. В структуре гликопротеинов связь углевода с белковым компонентом обычно осуществляется через остатки таких аминокислот, как серин или аспаргин.

Функции гликопротеинов:
- Входят в состав клеточной стенки бактерий, костной соединительной и хрящевой ткани, окружают волокна коллагена, эластина.
- Играют защитную роль. Например, данную структуру имеют антитела, интерфероны, факторы свертываемости крови (протромбин, фибриноген).
- Являются рецепторами, которые взаимодействуют с эффектором – небольшой небелковой молекулой. Последняя, присоединяясь к белку, приводит к изменению его конформации, что приводит к определенному внутриклеточному ответу.
- Выполняют гормональную функцию. К гликопротеинам относится гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Транспортируют вещества в крови и ионы через клеточную мембрану (трансферрин, транскортин, альбумин, Na+ ,К+ -АТФаза).
К гликопротеиновым ферментам относятся холинэстераза и нуклеаза.
Подробнее о протеогликанах
Обычно сложный белок протеогликан включает в свою структуру большие углеводные цепи с повторяющимися дисахаридными остатками, состоящими из какой-либо уроновой кислоты и аминосахара. Олиго- или полисахаридные цепи называются гликанами. Первые обычно содержат 2-10 мономерных единиц.
В зависимости от структуры углеводных цепей выделяют их различные типы, например, кислые гетерополисахариды с большим количеством кислотных групп или гликозаминогликаны, включающие аминогруппы. К последним относятся:
- Гиалуроновая кислота, которую активно применяют в косметологии.
- Гепарин, препятствующий свертываемости крови.
- Кератансульфаты – компоненты хрящевой ткани и роговицы.
- Хондроитинсульфаты входят в состав хряща и синовиальной жидкости.
Данные полимеры – компоненты протеогликанов, которые заполняют межклеточное пространство, удерживают воду, смазывают подвижные части суставов, являются их структурными составляющими. Гидрофильность (хорошая растворимость в воде) протеогликанов позволяет им в межклеточном пространстве создавать преграду для крупных молекул и микроорганизмов. С их помощью создается желеобразный матрикс, в который погружены волокна других важных белков, например, коллагена. Его тяжи в среде протеогликана имеют древовидную форму.
Особенности и типы липопротеидов
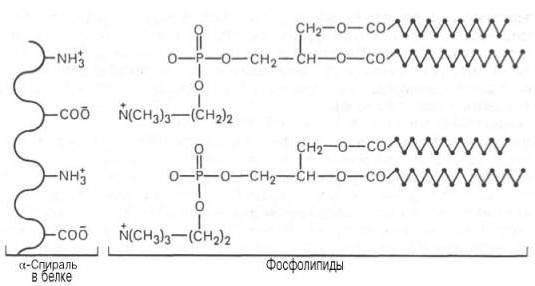
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.

Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Среди металлопротеинов много важных ферментов
Металлопротеин может включать в себя ионы нескольких металлов. Их наличие влияет на ориентацию субстрата в активном (каталитическом) центре фермента. Ионы металлов локализуются в активном центре и играют важную роль в проведении каталитической реакции. Часто ион выполняет функцию акцептора электронов.
Примеры металлов, содержащихся в структуре ферментных металлопротеинов:
- Медь включена в состав цитохромоксидазы, которая наряду с гемом содержит ион данного металла. Фермент участвует в процессе образования АТФ при работе дыхательной цепи.
- Железо содержат такие ферменты, как ферритин, выполняющий функцию депонирования железа в клетке; трансферрин – переносчик железа в крови; каталаза ответственна за реакцию обезвреживания перекиси водорода.
- Цинк – металл, характерный для алкогольдегидрогеназы, участвующей в окислении этилового и подобных ему спиртов; лактатдегидрогеназа – фермент в метаболизме молочной кислоты; карбоангидраза, катализирующая образование угольной кислоты из CO2 и h3O; щелочная фосфатаза, выполняющая гидролитическое расщепление эфиров фосфорной кислоты с различными соединениями; α2-макроглобулин – антипротеазный кровяной белок.
- Селен входит в состав тиреопероксидазы, участвующей в процессе образования гормонов щитовидной железы; глутатионпероксидазы, выполняющей антиоксидантную функцию.
- Кальций характерен для структуры α-амилазы – фермента гидролитического расщепления крахмала.
Фосфопротеины
Что входит в состав сложных белков фосфопротеинов? Для данной категории характерно присутствие фосфатной группы, которая связана с белковой частью через аминокислоты с гидроксилом (тирозин, серин или треонин). Какие функции выполняет фосфорная кислота, находясь в структуре белка? Она изменяет структуру молекулы, придает ей заряд, повышает растворимость, влияет на свойства белка. Примерами фосфопротеинов являются казеин молока и яичный альбумин, но в основном к данной категории сложных белков относятся ферменты.

Фосфатная группа играет важную функциональную роль, так как многие белки связаны с ней не постоянно. В клетке все время происходят процессы фосфорилирования и дефосфорилирования. В результате выполняется регуляция в работе белков. Например, если гистоны – белки, соединенные с нуклеиновыми кислотами переходят в фосфорилированное состояние, то активность генома (генетического материала) возрастает. От фосфорилирования зависит активность таких ферментов, как гликогенсинтаза и гликогенфосфорилаза.
Нуклеопротеины
Нуклеопротеины – белки, соединенные с нуклеиновыми кислотами. Они – неотъемлемая часть хранения и регуляции генетического материала, работы рибосом, выполняющих функцию синтеза белка. Самые простейшие формы жизни вирусов можно назвать рибо- и дезоксирибонуклеопротеинами, так как они состоят из генетического материала и белков.
Как происходит взаимодействие дезоксирибонуклеиновой кислоты (ДНК) и гистонов? В хроматине выделяют 2 вида белков, связанных с ДНК (гистоновые и негистоновые). Первые участвуют на начальной стадии компактизации ДНК. Молекула нуклеиновой кислоты обвивается вокруг протеинов с формированием нуклеосом. Образовавшаяся нить похожа на бусины, из них формируются суперспирализованная структура (хроматиновая фибрилла) и суперспираль (хромонема интерфазы). За счет действия гистоновых белков и протеинов более высоких уровней обеспечивается сокращением размерности ДНК в тысячи раз. Достаточно сравнить размер хромосом и длину нуклеиновой кислоты, чтобы оценить важность белков (6-9 см и 10-6 мкм, соответственно).
Какие бывают хромопротеины
Хромопротеины содержат весьма разнообразные группы, которые объединяет только одно – наличие окраски в простетическом компоненте. Сложные белки данной категории подразделяются на: гемопротеины (содержат в структуре гем), ретинальпротеины (витамин А), флавопротеины (витамин В2), кобамидпротеины (витамин В12).
Гемопротеины классифицируются в зависимости от функций на не ферментативные (гемоглобиновый и миоглобиновый белок) и ферменты (цитохромы, каталазы, пероксидазы).
Флавопротеины содержат в качестве простетического компонента производные витамина В2 флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД). Данные ферменты также участвуют в окислительно-восстановительных превращениях. К ним относятся оксидоредуктазы.
Что такое цитохромы?
Как было описано выше, гем состоит из порфирина. В его структуру входят 4 пиррольных кольца и двухвалентное железо. Особая группа гемовых ферментов – цитохромы, различающиеся составом аминокислот и числом пептидных цепей, специализированы на проведении окислительно-восстановительных реакций, за счет которых обеспечивается перенос электронов в дыхательной цепи. Данные ферменты участвуют в микросомальном окислении – начальных реакциях биотрансформации ксенобиотиков, приводящих к их обезвреживанию, и обмене многих экзогенных и экзогенных веществ, например, стероидов, насыщенных жирных кислот.
Влияние простетической группы
Простетическая группа, входящая в состав сложных белков, влияет на его свойства: изменяет его заряд, растворимость, термопластичность. Например, таким действием обладают остатки фосфорной кислоты или моносахаридов. Углеводная часть, включенная в состав сложного белка, защищает его от протеолиза (разрушения в результате процесса гидролиза), влияет на проникновение молекул через клеточную мембрану, их секрецию и сортировку. Липидный фрагмент позволяет создавать белковые каналы для транспорта плохо растворимых в воде (гидрофобных) соединений.
Строение и функции сложных белков полностью зависят от простетической группы. Например, с помощью железосодержащего гема в гемоглобине происходит связывание кислорода и углекислого газа. За счет нуклеопротеидов, формируемых в результате взаимодействия гистонов, протаминов с ДНК или РНК, происходит защита генетического материала, его компактное хранение, связывание РНК в процессе синтеза белков. Нуклеопротеидами называют устойчивые комплексы белков и нуклеиновых кислот.
Заключение
Таким образом, сложные белки выполняют большой спектр функций в организме. Поэтому потребление макро- и микроэлементов так важно для поддержания здоровья. Металлы входят в состав многих ферментов. Зная биохимию, особенности своего здоровья и экологическое состояние места проживания, можно скорректировать режим собственного питания. Например, выделяют территории, отличающиеся дефицитом какого-либо элемента. Его дополнительное внесение в рацион в виде добавок позволяет восполнить недостаток.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Автомобили Трансмиссионные масла: классификация и характеристики
Автомобили Трансмиссионные масла: классификация и характеристикиТрансмиссионные масла – специальный класс машинных масел, предназначенный для использования в разных узлах трения трансмиссий транспортных средств, а также в разнообразных редукторах. Моторные и трансмиссионные ...
 Бизнес Виды упаковок. Упаковка товаров, ее функции, виды и характеристики
Бизнес Виды упаковок. Упаковка товаров, ее функции, виды и характеристикиКаждый из нас знает, что такое упаковка. Но далеко не все понимают, что она служит не только для придания товарного вида изделию и более комфортной его транспортировки. Некоторые виды упаковок нужны исключительно для ...
 Бизнес Химически опасные объекты: понятие, классификация и характеристика
Бизнес Химически опасные объекты: понятие, классификация и характеристикаХимически опасные объекты - это объекты (будь то лаборатории, учреждения либо пре...
 Здоровье Медицинское имущество и его учет. Обеспечение медицинским имуществом. Медицинское имущество: классификация и характеристика
Здоровье Медицинское имущество и его учет. Обеспечение медицинским имуществом. Медицинское имущество: классификация и характеристикаМедицинское имущество представляет собой комплекс особых материальных средств. Они предназначены для оказания помощи, лечения, диагностики, профилактики патологий и поражений, осуществления противоэпидемических, а так...
 Образование Аварийно химически опасное вещество. Классификация и характеристики химически опасных веществ
Образование Аварийно химически опасное вещество. Классификация и характеристики химически опасных веществМногие из нас в своей жизни сталкивались с опасными и ядовитыми веществами, а некоторые даже могли погибнуть из-за паров, которые исходят от них. Это может быть связано со спецификой работы на некоторых предприятиях. ...
 Финансы Структура бухгалтерии: описание и характеристика
Финансы Структура бухгалтерии: описание и характеристикаБухгалтерский отдел представляет собой в достаточной степени самостоятельное подразделение любой современной компании. Он может состоять из звеньев различного назначения, каждое из которых призвано выполнять строго от...
 Домашний уют Виды электроинструментов: классификация и характеристики, назначение и применение
Домашний уют Виды электроинструментов: классификация и характеристики, назначение и применениеНа рынке ассортимент электроинструментов большой, но не каждый знает, как сделать правильный выбор. Поэтому стоит перед началом понять классификацию и назначение изделий. Для каждого требуется свое оборудование и инст...
 Образование Классификация и характеристика методов обучения
Образование Классификация и характеристика методов обученияИспользуя различные методы обучения, учитель передает своим воспитанникам знания. При этом хороший педагог всегда стремится получить наилучшие результаты. Необходимым условием для этого является сочетание различных ме...
 Закон Как оформить ДТП без вызова ГИБДД: виды, классификация и характеристика происшествия, соблюдение необходимых условий и правила оформления европротокола
Закон Как оформить ДТП без вызова ГИБДД: виды, классификация и характеристика происшествия, соблюдение необходимых условий и правила оформления европротоколаДорожные происшествия считаются неприятными ситуациями, при которых может наноситься урон имуществу или здоровью граждан. Относительно недавно такие ситуации требовали непременного привлечения работников ГИБДД, но теп...
 Здоровье Кровопотеря: степени тяжести, классификация и характеристика, симптомы, оказание первой помощи и лечение
Здоровье Кровопотеря: степени тяжести, классификация и характеристика, симптомы, оказание первой помощи и лечениеКровотечением называется процесс излияния крови из сосудов, который происходит из-за нарушений целостности оболочки их стенок. Специалисты выделяют разные степени кровопотери (например, травматическую, нетравматическу...
monateka.com
Классификация сложных белков
1. Нуклеопротеины. Имеют важное значение, так как их небелковая часть представлена нуклеиновыми кислотами: дезоксирибонуклеиновой (ДНК) и рибонуклеиновой (РНК). Нуклеиновые кислоты участвуют в хранении и передаче наследственной информации о первичной структуре белков, специфичных для данного организма. Белковая часть нуклеопротеинов представлена в основном протаминами и гистонами.
2.Хромопротеины. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями. К хромопротеинам относятся гемоглобин, миоглобин (белок мышц), церулоплазмин. Гемоглобин (Нb) состоит из белка глобина и небелковой части - гема, в составе которого имеется атом двухвалентного железа и окрашен в красный цвет. Белок крови церулоплазмин, содержащий медь, окрашен в голубой цвет.
3. Липопротеины сложные белки, простетическая группа которых образована липидами. Они являются обязательными компонентами клеточных мембран, содержатся в миелиновых оболочках нервных клеток, а также в синаптических мембранах и внутренних мембранах митохондрий.
4. Гликопротеины. Представляют собой сложные белки, простетическая группа которых образована углеводами. Гликопротеины входят в состав клеточных мембран, участвуют в транспорте различных веществ, в процессах свертывания крови, иммунитета (иммуноглобулины), образуют матрикс межклеточного пространства.
5. Фосфопротеины. Содержат в качестве небелкового компонента фосфорную кислоту. К фосфопротеинам относятся многие белки, играющие роль в питании молодых организмов. Это основные белки молока - казеин, яичного желтка – вителлин и фосвитин, икры рыб – ихтулин. Они содержат до 10% фосфатов. Фосфопротеины обнаружены также в мозге.
6. Металлопротеины. Имеют в качестве небелкового компонента ионы металлов. Примером может служить алкогольдегидрогеназа, содержащая цинк. К медьсодержащим белкам относятся цитохромоксидаза, церулоплазмин, к железосодержащим – лактоферрин молока, трансферрин. В мышечной ткани животных обнаружен селенопротеин.
1.9 Функции белков
1. Ферментативная или каталитическая .
Одна из наиболее распространенных функций белков, которая состоит в ускорении химических превращений.
2. Гормональная или регуляторная.
Реализуется гормонами белковой природы (инсулин, лютропин).
3. Рецепторная.
Избирательное связывание различных регуляторов (гормонов, медиаторов ) на поверхности клеточных мембран или внутри клеток.
4. Транспортная.
Связывание и транспорт веществ между тканями и через мембрану, например:
гемоглобин - кислород;
липопротеины – холестерин и триацилглицерины;
альбумины - гормоны, жирные кислоты, билирубин, минеральные вещества.
5. Структурная .
Белки мембран, белки нуклеосом, эластин соединительной ткани, фибрин тромбов.
6. Опорная или механическая.
Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур (коллаген).
7. Резервная или трофическая.
Использование белков как запасного материала для питания развивающихся клеток. Эта функция характерна только для белков зародышевых клеток.
8. Энергетическая.
Белок используется как субстрат для образования энергии (все белки).
9. Сократительная присуща сократительным белкам мышц миозину и актину, а также белкам жгутиков, которые обеспечивают двигательную функцию.
10. Защитная.
Реализуется иммуноглобулинами, фибриногеном, плазмином и другими белками.
28
studfiles.net
Значение словосочетания СЛОЖНЫЕ БЕЛКИ. Что такое СЛОЖНЫЕ БЕЛКИ?
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом.
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока:
Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
kartaslov.ru
Сложный белок Википедия
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
- Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
- Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
- Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
- Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
- Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
- Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлосодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
Примечания[ | код]
ru-wiki.ru
Сложный белок Википедия
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
- Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
- Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
- Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
- Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
- Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
- Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлосодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
Примечания
wikiredia.ru
Сложный белок - Справочник химика 21
Казеин — сложный белок — фосфопротеид, весьма ценный источник аминокислот он содержит все необходимые организму аминокислоты. В виде комплексного соединения с аммиаком или кислотного гидролизата он хорощо усваивается кожей. Соединения казеина со щелочами — хорошие эмульгаторы. [c.80]Что такое фермент Простетическая группа Сложный белок Кофермент Субстрат [c.427]
Более подробно выяснено значение витамина А в процессе свето-ощущения. В этом важном физиологическом процессе большую роль играет особый хромолипопротеин—сложный белок родопсин, или зрительный пурпур, являющийся основным светочувствительным пигментом сетчатки, в частности палочек, занимающих ее периферическую часть. Установлено, что родопсин состоит из липопротеина опсина и простетической группы, представленной альдегидом витамина А (ретиналь) связь между ними осуществляется через альдегидную группу витамина и свободную -КН,-группу лизина молекулы белка с образованием шиффова основания. На свету родопсин расщепляется на белок опсин и ретиналь последний подвергается серии конформационных изменений и превращению в транс-форму. С этими превращениями каким-то образом связана трансформация энергии световых лучей в зрительное возбуждение—процесс, молекулярный механизм которого до сих пор остается загадкой. В темноте происходит обратный процесс—синтез родопсина, требующий наличия активной формы альдегида—11-гретиналя, который может синтезироваться из -ретинола, или транс-ретиналя, или транс-формы витамина А при участии двух специфических ферментов—дегидрогеназы и изомеразы. Более подробно цикл превращений родопсина в сетчатке глаза на свету и в темноте можно представить в виде схемы [c.211]Кератин — сложный белок. При разрыве дисульфидных связей в результате его окисления или восстановления получается [c.258]
Казеин — сложный белок, образующийся из казеиногена (важнейшая составная часть молока, творога и сыра) при его свертывании под действием ферментов. Кроме атомов углерода, водорода, кислорода и азота в казеине содержится фосфор. Точное строение молекулы казеина не выяснено. [c.38]
Представителем может служить гемоглобин — сложный белок, состоящий из небелковой части (гема) и белка (глобина). [c.73]
Ферменты представляют собой вещества белковой природы. Многие из них содержат и небелковый компонент, образуя сложный белок (дегидразы, оксидазы и др.). Ряд ферментов получен теперь в кристаллическом виде (пепсин, трипсин, уреаза, каталаза, амилаза и др.). [c.49]
Рибосомы представляют собой миниатюрные, но чрезвычайно сложные белок-синтезирующие системы. Каждая рибосома Е. соИ обладает массой 2,7-10 дальтон и состоит на 65% из особой рибосомной РНК и на 35% из белка. В структуру рибосомы входит около 50 различных белков. Рибосомы способны считывать генетическую информацию с мРИК и точно собирать именно такую белковую молекулу, которая детерминируется соответствующим геном (трансляция генетической информации). [c.19]
Если сложный белок является ферментом, то его просте- [c.66]
В клетках Salmonella typhimurium ферменты биосинтеза гистидина детерминируются в общей сложности десятью различными генами. Они образуют единый кластер — гистидиновый оперон, представляющий собой последовательную группу генов, транскрибируемых в виде единой молекулы информационной РНК [143]. Символы этих генов His А, His В и т. д. приведены на рис. 14-28, а их локализация на генетической карте Е.соИ показана на рис, 15-1. Ген His В детерминирует сложный белок с двумя независимыми ферментативными активностями (рис. 14-28). [c.160]
Основываясь на этих данных, Вильштеттер не только не разделял мнения Ненцкого о химическом и генетическом сродстве хлорофилла и гемоглобина, а, наоборот, всегда стремился подчеркнуть различие между этими биохромами, отмечая наличие разных металлов в их молекулах (у хлорофилла — магний, у гемоглобина — железо), различие в самом химическом строении (хлорофилл — сложный эфир двухосновной кислоты, гемоглобин—сложный белок), а главное противоположный характер осуществляемых функций (фотосинтез и дыхание). [c.173]
Протеид — сложный белок, представляющий собой кo шлeк протеина с небелковым компонентом. [c.440]
Считают, что у здоровых людей желудочный/сок содержит белок-мукопротеид — внутренний фактор Касл а, который соединяется с витамином В12 ( внешний фактор ), образуя новый, сложный белок. Витамин В а, связанный в таком белковом комплексе, может успешно всасываться из кишечника. При отсутствии внутреннего фактора всасывание витамина В12 резко нарушается. У больных злокачественной анемией в желудочном соке белок, необходимый для образования комплекса с витамином В 2> отсутствует. [c.184]
При термической обработке продуктов изменяются не только глобулярные белки, но и фибриллярные — в основном коллаген. Изменение коллагена не связано с денатурацией, а вызывается разрывом водородных связей между полипептидными цепочками вторичной структуры белка. При нагревании волокна коллагена сокращаются по длине в 3—4 раза, но значительно увеличиваются в объеме и приобретают эластичность. Все это приводит к полному нарушению фибриллярной структуры коллагена, к необратимой его дезагрегации. В результате сложный белок коллаген упрощается и переходит в более простой, хорошо растворимый в горячей воде, легче усвояемый белок — глютин. [c.215]
Первый продукт, образующийся при освещении каротиноид-ного компонента зрительного пурпура, получил название переходного оранжевого. Он стоек при температуре около 0°, при комнатной же температуре он превращается в индикаторный желтый, который в щелочном р.астворе теряет свою окраску [35] Индикаторный желтый представляет собой сложный белок, в котором альдегидная группа ретинена соединена, вероятно, с ка-кой-либо аминогруппой белкового компонента [36]. При фотолизе сухого зрительного пурпура витамин А не образуется [34, 37]. При обработке бензином или хлороформом зрительный пурпур не изменяется, при обработке же этиловым или метиловым спиртом он мгновенно превращается в желтое вещество. Поскольку ретинен имеет желтый цвет, а витамин А бесцветен, ни первый, ни второй не могут рассматриваться как простетическая группа зрительного пурпура таким образом, мы до сих пор ничего не можем сказать о строении вещества, обусловливающего интенсивную окраску и светочувствительность зрительного пурпура. [c.232]
Кожа содержит сложный белок коллаген, характеризующийся высоким содержанием пролина и гидроксипролина. Различные коллагены отличаются друг от друга по составу. Выделенный из коллагена фрагмент Gly—Pro—X—Gly—Pro—X при кислотном и ферментативном гидролизе расщепляется по связи X—Gly, что позволило сделать вывод [c.164]
Казеиноген — белок молока, на долю которого приходится основное содержание белка в молоке. В желудке превращается в казеин. Казеиноген — запасной белок. Это сложный белок-фос протеид. [c.20]
Например, гемоглобин (белок крови) — это сложный белок, макромолекула которого состоит из четырех полипеп- тидных цепей (глобул), соеди- [c.707]
КАЗЕИН (лат. aseus — сыр) — фосфопротеид, сложный белок, главный [c.113]
Из простых белков следует назвать альбумин и глобулин. К более сложным белкам относятся казеин, кератины и коллагиг, К,азеин — сложный белок, образующийся из казеиногена (важнейшая составная часть молока, творога и сыра) при его сверты- [c.36]
Окисление цитохрома с сопровождается появпением мембранного протонного потенциала ДцН, к- ый используется клеткой для обеспечения всех вцдов работ, выполняемых биомембранами, и в первую очередь для синтеза АТФ. Фермент широко распространен как среди эукариот, так и среди прокариот. У эукгфиот фермент расположен во внутр. мембране митохондрий, у прокариот - в цитоплазматич. мембране. Ц,- сложный белок, состоящий из неск. полипептидных [c.389]
Кератин — сложный белок. Прп разрыве дисульфидных связей в результате окисления или восстановления получается растворимое вещество, из которого можно выделить две фракции — бедную и богатую серой. Первая состоит из фибриллярных, вторая — из глобулярных молекул. Вероятно, глобулярные молекулы служат сшивками в кератиновых волокнах. Структурная единица волокна есть цилиндрическая микрофибрилла диаметром коло 7,5 нм, построенная из белков с малым содержанием серы. На рис. 4.29 показана гипотетическая модель волокна а-керати-на. Регулярно уложенные участки являются а-спиралями, скрученными попарно. Белок гетерогенен и состоит из двух главных компонент в отношении 2 1. Отдельные молекулы могут располагаться либо последовательно (рис. 4.29,6, в), либо параллель-ло друг другу (рис. 4.29, г). Опыт дает большие периоды вдоль волокна, равные 20 нм, что согласуется с моделями рис. 4,29, виг, во не 4.29, б. [c.128]
Казеин — сложный белок, образующийся из казеиногена (ва нейшая составная часть молока, творога и сыра) при его свертц [c.36]
Трансляция осуществляется в клетках при помощи сложной белок-синтези-рующей системы. Отдельные компоненты этой системы ассоциируют в единую структуру по мере ее функционирования и разобщаются по окончанию синтеза. В состав белок-синтезирующей системы входят следующие структуры [c.463]
Гемоглобин — дыхательный пигмент, содержащийся в эритроцитах и обусловливающий цвет крови, Представляет собой сложный белок, образованный белком глобином, связанным с гвмом. Осуществляет транспорт кислорода из лепмх в ткани, а иэ последних СО в легкие. См. Гем. [c.73]
Гликопротвид — 1) сложный белок, в котором углеводный фрагмент ковалентно связан с полипептидными цепями белка О- или М-гликозид-ными связями 2) сложные белки, простетической группой которых являются углеводы. [c.82]
В организме взрослого человека содержится 4—5 г железа, нз них 65 % Ре находится в крови. С помощью железосодержащего белка ферритииа железо накапливается в печени, костном мозгу и селезенке. Плазма крови, молоко и яичный белок содержат сложный белок трансферрин, участвующий в переносе ионов железа (П1). [c.425]
КАЗЕЙН м. Сложный белок, образуюгцийся при створаживании молока под действием ферментов применяется в производстве клеев, пластмасс, красок и др. [c.163]
Наиболее важным волокнообразующим материалом у животных является сложный белок коллаген, присутствующий во всех частях их тела. Особенно много его содержится в шкуре, костной ткани и мышцах, однако он находится также во внутренних органах и в глазах. Кожу получают путем специальной обработки шкур животных, и для технологии кожевенного производства большое значение имеет понимание молекулярной и надмолекулярной структуры коллагеновых волокон. В дермисе шкуры эти волокна тесно и беспорядочно переплетаются, образуя плотную пространственную сетку, напоминающую войлок. Таким образом, кожу можно рассматривать как природный нетканый материал. [c.296]
Специфическим признаком ретинолавитаминоза у детей является поражение роговой оболочки глаза, приводящее к ксерофтальмии (сухость роговицы глаз) и в тяжелых случаях заболевания—к кератомаляции (изъязвление роговой оболочки глаза). У взрослых авитаминоз проявляется в потере способности видеть в сумерках, отчего заболевание получило название куриная слепота , или гемералопия. Куриная слепота возникает вследствие недостаточного образования зрительного пурпура — родопсина в клетках сетчатки глаза, называемых палочками. Родопсин—это сложный белок, в состав которого, кроме белка опсина, входит продукт окисления ретинола—11-цис-ретинен (альдегид). При недостатке ретинола наблюдается пониженная сопротивляемость организма инфекционным заболеваниям, повышенная утомляемость и задержка роста. [c.77]
Нуклеопротеидами, тромбоциты содержат липопротеид про-тромбокиназу, в состав простетической группы которого входит кефалин. Содержание гемоглобина в эритроцитах доходит до 40%. В цельной крови взрослого человека содержание гемоглобина составляет 12—14%, что соответствует 75—85% по гемометру Сали Ч Кроме гемоглобина, в эритроцитах содержится сложный белок, содержащий медь, называемый купреином, и фермент карбоангидраза, в состав которого входит цинк. Из небелковых органических веществ в эритроцитах содержится в среднем 350 мг% лецитина, 150 мг% холестерина и др. Содержание глюкозы в эритроцитах меньше, чем в плазме, и составляет 60—70 мг%. Из минеральных веществ в эритроцитах содержится особенно много калия (около 470 мг%) и железа (около 105 мг%) и очень мало натрия (около 80 мг%). [c.226]
Липопротенн. Сложный белок, содержащий липид или группу липидов. [c.1013]
Сложный белок. Белок, содержащий в качестве простетической группы металл или органическое соединение, или и то, и другое. [c.1018]
Глюкозооксидаза — сложный белок она представляет собой флавопротеид, в котором одна частица протеина связана с двумя молекулами кофермента — флавинаденин-динуклеотида (ФАД). Механизм ее действия состоит в том, что в первой стадии реакции она катализирует отнятие двух атомов водорода у первого С-ато- [c.272]
При циклическом электронном транспорте ферредоксин может восстанавливать окисленную фор У цитохрома В-типа (цитохрома Ее), имеющего в восстановленном состоянии характерную полосу поглощения в области 563 нм. Цитохром Ве автооксидабе-лен (т. е. может окисляться кислородом воздуха), имеет Е = —0,06 в. Это соединение представляет собой сложный белок — хромопротеид с железосодержащим порфириновым кольцом, в котором содержатся две дополнительные (по сравнению с цитохромами С-типа) винильные группы, увеличивающие систему те-электронов порфирина с 26 до 30. Этот переносчик вымывается из хлоропластов лишь при использовании ионных детергентов. Попытки очистки цитохрома Ве не удались. [c.161]
П. — сложный белок — гликопротеид, мол. в. 108 000—127 ООО, в состав к-рого, помимо аминокислот, входит до 1,5% гексоз. П. растворим в воде при pH ниже 5 и выше 9 плохо растворим при средних значениях pH. Ирп pH 2, 3—3,0 водные р-ры П. весьма устойчивы, в нейтральных р-рах П. подвергается быстрому самопсревариванию (см. Аутолиз). В крови животных и человека П. находится в форме неактивного предшественника и л а з м и н о г е п а (и р о-ф и б р и н о л и 3 и н а), к-рый под действием ряда факторов, присутствующих в крови и различных тканях, превращается в П. В частности, превращение плазминогена в II. катализируется самим Н. (автокатализ), а также трипсином и уроки на- [c.22]
Гемоглобин и глобин. В красных кровяных шариках находится сложный белок гемоглобин, играющий большую роль в процессах дыхания животных и человека. При окислении (дыхании) гемоглобин превращается в оксигемоглобин. Оксигемоглобин крови состоит из белкового вещества глобина и красящего вещества гематина, Сз4Нз2М404ре(0Н), который в присутствии Na l превращается в гемин, 34h42N404Fe l, в виде характерных кристаллов. Молекула гемина содержит четыре пиррольных ядра, связанных между собой группами СН, а также с атомом железа [c.354]
Лютропин (лютеинизирующий гормон, ЛГ) — гормон передней доли гипофиза, который вырабатывают специализированные клетки аденогипофиза. У самок он вызывает разрыв фолликула с образованием желтого тела, у самцов стимулирует развитие интерстициальной ткани и секрецию тестостерона. ЛГ — сложный белок-глтокопротеид, имеющий мол. массу у овец 40 ООО, у свиней — 100 ООО. Его молекула состоит из дву а- и Р-субъединиц. Установлена последовательность аминокислотных остатков а-субъединицы овцы, свиньи и человека и локализация пяти дисульфидных связей в а-субъединице ЛГ овцы. Структура а-субъединицы у человека отличается от ее структуры у овцы 22 аминокислотными остатками, а у свиньи—пятью. ЛГ человека укорочена с №конца на семь остатков, а свиньи — на шесть. а-Суф.е-диница ЛГ состоит из 96 аминокислотных остатков и имеет два углеродных радикала, присоединенных по остаткам аспарагина в 56-м и 82-м положениях- [c.279]
Гемоглобин, придающий окраску красным кровяным тельцам, представляет собой сложный белок. Гемоглобин состоит из белковой части (глобин) и четырех гемов. Гем — это соединение протопор-фирина с ионом железа. Молекулярный вес гемоглобина человека колеблется от 63 ООО до 67 ООО. [c.362]
chem21.info
Сложный белок Вики
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
- Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
- Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
- Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
- Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
- Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
- Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлосодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
Примечания[ | код]
ru.wikibedia.ru











