как разделить воду на водород и кислород. Как разложить воду на кислород и водород в домашних условиях
Ученые расщепили воду на водород и кислород, используя обычную батарейку
Ученые из Стэнфордского университета разработали необычное устройство, которое использует обычную 1,5-вольтовую батарейку, для расщепления воды на водород и кислород при комнатной температуре. Их разработка может являться дешевым и удобным способом для производства горючего для водородных автомобилей.
Расщепитель воды производится из относительно дешевых металлов, никеля и железа, через которые пропускается ток от обычной батарейки типа ААА, сообщает ресурс Gizmag.
«Нам впервые удалось расщепить воду при низком напряжении, используя недорогие металлы. Это очень важно, ведь ранее для подобных целей использовались дорогие металлы, такие как платина или иридий», — говорит ведущий исследователь Hongjie Dai.
Технология имеет огромный потенциал в качестве источника питания для водородных двигателей, которые уже давно пророчат на смену бензиновым. В отличие от бензиновых двигателей, которые производят много вредных выбросов в атмосферу, в качестве побочного продукта у водородных агрегатов является вода.
Ранее водородные двигатели критиковали за их высокую стоимость, отсутствие развитой инфраструктуры и низкую энергоэффективность. Однако, по мнению исследователей из Стэнфордского университета, их изобретение может значительно исправить большинство этих недостатков.
«На протяжении многих лет ученые пытались сделать недорогие электрокатализаторы с высокой эффективностью и длительным сроком службы. Когда мы обнаружили, что никель является столь же эффективным, как и платина, это стало для нас неожиданностью», — объясняет Hongjie Dai.
Катализатор из никеля и оксида никеля требует для расщепления воды значительно меньшее напряжение, по сравнению с чистым никелем или чистым оксидом никеля. Однако, как сообщают создатели, данная технология еще довольно «сырая» и не совсем готова для коммерческого использования.
В будущем ученые планируют разработать катализатор, работающий от солнечной энергии вместо батарейки. Ведь исследователи полагают, что их изобретение может существенно повлиять на производство водородных автомобилей. Кстати, напомним, что компания Toyota, планирует в следующем году представить автомобиль с двигателем, работающем на водороде.
hi-news.ru
Расщепление воды на водород и кислород | Водопровод
 » Водопровод
» Водопровод
Банк идей cегодня идей в Базе - 751
Расщепить воду на водород и кислород
Дата публикации: 06.07.
Водород как источник энергии привлекает своей экологической безопасностью. Ведь при его сжигании образуются только водяной пар. На Земле, запасы водорода в связанном состоянии в виде воды неисчерпаемы. Добыть водород из воды можно при помощи хорошо известного химического эффекта, называемого электролиз. Электрический ток разлагает воду на водород и кислород. Однако чтобы получать водород таким способом в промышленных масштабах, необходимо затратить огромное количество электроэнергии. А как можно в промышленных масштабах расщеплять воду на водород и кислород без использования электрического тока?
. Вспомним о хорошо известном биологическом эффекте биосинтеза, когда растения, без ничего , используя бесплатные ресурсы (солнечный свет, воду и углекислый газ) выделяют в окружающую среду кислород. Причём, этот кислород получается в результате расщепления воды. Может, можно подыскать подходящий биологический эффект, позволяющий расщеплять воду на водород и кислород, используя в качестве источника энергии солнечный свет?
Оказывается, что для расщепления молекул воды на водород и кислород можно использовать фотоэлектрохимический эффект. Фотоэлектрохимическая ячейка включает в себя погруженный в воду электрод, созданный на основе наночастиц природного материала гематита (разновидность оксида железа), покрытых сетью из зелёного белкового пигмента фикоцианина, содержащегося в сине-зелёных водораслях (рис.1).

Рис.1. Фрагмент фотоэлектрохимического электрода под электронным микроскопом. Красный фон - наночастицы гематита, зелёные нити - фикоцианин.
При облучении погруженного в воду поверхности этого электрода солнечным светом, электрод вырабатывает электрический ток, а электрический ток разлагает молекулы воды на водород и кислород. Полученный белковый комплекс на поверхности пластины оказался довольно стойким и не разрушался при контакте с оксидом железа в щелочной среде, на ярком свете.
Эта разработка представляет несомненный интерес в качестве возможного способа производства водородного топлива. Осталось выяснить, как наладить массовое производство этих электродов и как они будут работать в реальных условиях эксплуатации.
Ученые расщепили воду на водород и кислород, используя обычную батарейку

Ученые из Стэнфордского университета разработали необычное устройство, которое использует обычную 1,5-вольтовую батарейку, для расщепления воды на водород и кислород при комнатной температуре. Их разработка может являться дешевым и удобным способом для производства горючего для водородных автомобилей .
Расщепитель воды производится из относительно дешевых металлов, никеля и железа, через которые пропускается ток от обычной батарейки типа ААА, сообщает ресурс Gizmag.
«Нам впервые удалось расщепить воду при низком напряжении, используя недорогие металлы. Это очень важно, ведь ранее для подобных целей использовались дорогие металлы, такие как платина или иридий», говорит ведущий исследователь Hongjie Dai.
Технология имеет огромный потенциал в качестве источника питания для водородных двигателей, которые уже давно пророчат на смену бензиновым. В отличие от бензиновых двигателей, которые производят много вредных выбросов в атмосферу, в качестве побочного продукта у водородных агрегатов является вода.
Ранее водородные двигатели критиковали за их высокую стоимость, отсутствие развитой инфраструктуры и низкую энергоэффективность. Однако, по мнению исследователей из Стэнфордского университета, их изобретение может значительно исправить большинство этих недостатков.
«На протяжении многих лет ученые пытались сделать недорогие электрокатализаторы с высокой эффективностью и длительным сроком службы. Когда мы обнаружили, что никель является столь же эффективным, как и платина, это стало для нас неожиданностью», объясняет Hongjie Dai.
Катализатор из никеля и оксида никеля требует для расщепления воды значительно меньшее напряжение, по сравнению с чистым никелем или чистым оксидом никеля. Однако, как сообщают создатели, данная технология еще довольно «сырая» и не совсем готова для коммерческого использования.
В будущем ученые планируют разработать катализатор, работающий от солнечной энергии вместо батарейки. Ведь исследователи полагают, что их изобретение может существенно повлиять на производство водородных автомобилей. Кстати, напомним, что компания Toyota, планирует в следующем году представить автомобиль с двигателем, работающем на водороде .
Каким образом можно воду расщепить на водород и кислород?
kudec Гуру (4476) 6 лет назад
А в чем проблема, в малых количествах можно и два любых электрода (проводок, пластинка) вставить в воду и дать постоянное напряжение порядка 10-20 вольт.
Marat Просветленный (25772) 6 лет назад
Это просто.
1) Нетрудно показать, что равновесие 2h3O = 2h3 + O2 сместится в прямом направлении при температуре порядка +2000С. Недостатком термического способа является большая энергоёмкость и наличие других равновесий (с участием, например пероксида водорода).
2) Химический способ. Вода может быть как окислителем, так и восстановителем. Из воды можно выделить кислород, окислив её свободным фтором: F2 + h3O = O2 + HF. С другой строны, активный щелочной металл запросто вытеснит из воды водород: Na + h3O = h3 + NaOH (данные реакции идут при нормальных условиях).
3) Облучение паров воды лазером с использованием фемтохимических методов. Существует множество различных путей реакции с участием взаимодействующих молекул h3O. Задавая последовательность лазерных импульсов в определённой последовательности и в определённом частотном диапазоне, можно заставить систему дать в конечном итоге именно h3 и O2. Здесь положение усугубляется спиновым запретом процессов элементарного акта, но и его можно снять.
4) Электролиз жидкой воды: пропускание тока через ячейку, заполненную водой (водным раствором). Тогда на аноде будет выделяться кислород, а на катоде - водород. Легко показать, что минимальное напряжение, необходимое для этого, составляет порядка 2.2 вольт (в реальности, разумеется, больше - из-за омических потерь в водном растворе). Этот способ разложения воды на простые вещества является, пожалуй, наиболее доступным.
Источники: http://www.trizland.ru/ideas/2441, http://hi-news.ru/technology/uchenye-rasshhepili-vodu-na-vodorod-i-kislorod-ispolzuya-obychnuyu-batarejku.html, http://otvet.mail.ru/question/28926714
Комментариев пока нет!restart24.ru
Как отделить кислород от водорода
Для этого нужен более сложный прибор — электролизер, который состоит из широкой загнутой трубки, наполненной раствором щелочи, в которую погружены два электрода из никеля.
Кислород будет выделяться в правом колене электролизера, куда подключен положительный полюс источника тока, а водород — в левом.
Это обычный тип электролизера, которым пользуются в лабораториях для получения небольших количеств чистого кислорода.
В больших количествах кислород получают в электролитических ваннах разнообразных типов.
Войдем в один из электрохимических заводов по производству кислорода и водорода. В огромных светлых залах-цехах строгими рядами стоят аппараты, к которым по медным шинам подводится постоянный ток. Это электролитические ванны. В них из воды можно получить кислород и водород.
Электролитическая ванна — сосуд, в котором параллельно друг другу расположены электроды. Сосуд наполняют раствором — электролитом. Число электродов в каждой ванне зависит от размера сосуда и от расстояния между электродами. По схеме включения электродов в электрическую цепь ванны делятся на однополярные (монополярные) и двухполярные (биполярные).
В монополярной ванне половина всех электродов подключается к положительному полюсу источника тока, а вторая половина — к отрицательному полюсу.
В такой ванне каждый электрод служит или анодом, или катодом, и на обеих сторонах его идет один и тот же процесс.
В биполярной ванне источник тока подключается только к крайним электродам, один из которых служит анодом, а другой — катодом. С анода ток поступает в электролит, через который он переносится ионами к близлежащему электроду и заряжает его отрицательно.
Проходя через электрод, ток снова входит в электролит, заряжая обратную сторону этого электрода положительно. Таким образом, проходя от одного электрода к другому, ток доходит до катода.
В биполярной ванне только анод и катод работают как монополярные электроды. Все же остальные электроды, расположенные между ними, являются с одной стороны катодами (—), а с другой стороны — анодами (+).
При прохождении электрического тока через ванну между электродами выделяются кислород и водород. Эти газы нужно отделить друг от друга и направить каждый по своему трубопроводу.
Существуют два способа отделения кислорода от водорода в электролитической ванне.
Первый из них заключается в том, что электроды отгораживаются друг от друга металлическими колоколами. Образующиеся на электродах газы поднимаются в виде пузырьков кверху и попадают каждый в свой колокол, откуда через верхний отвод направляются в трубопроводы.
Этим способом кислород легко отделить от водорода. Однако такое разделение приводит к излишним, непроизводительным затратам электроэнергии, так как электроды приходится ставить на большом расстоянии друг от друга.
Другой способ разделения кислорода и водорода при электролизе заключается в том, что между электродами ставится перегородка — диафрагма, которая является непроницаемой для пузырьков газа, но хорошо пропускает электрический ток. Диафрагма может быть сделана из плотно сотканной асбестовой ткани толщиной 1,5—2 миллиметра. Эту ткань натягивают между двумя стенками сосуда, создавая тем самым изолированные друг от друга катодные и анодные пространства.
Водород из всех катодных и кислород из всех анодных пространств поступают в сборные трубы. Оттуда по трубопроводам каждый газ направляется в отдельное помещение. В этих помещениях под давлением 150 атмосфер полученными газами наполняют стальные баллоны. Баллоны направляют во все уголки нашей страны. Кислород и водород находят широкое применение в различных областях народного хозяйства.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Водород из воды: просто и дешево - Наука
Российский исследователь сконструировал электролизер, позволяющий получать водород из воды, затрачивая на это очень мало энергии.
Водород — экологически чистый энергоноситель, к тому же практически неисчерпаемый. Согласно расчетам, из 1 л воды можно получить 1234, 44 л водорода. Однако переход энергетики на водородное топливо тормозят большие затраты энергии, необходимые для получения водорода из воды. Процесс электролиза идет при напряжении 1,6—2,0 В и силе тока в десятки и сотни ампер. Самые современные электролизеры расходуют на получение кубометра водорода больше энергии, чем можно получить при его сжигании (4 и 3,55 кВт.ч соответственно). Проблему уменьшения затрат энергии на получение водорода из воды решают многие лаборатории мира, но существенных результатов достичь пока не удалось. Однако в природе существует экономный процесс разложения молекул воды на водород и кислород. Протекает он при фотосинтезе. При этом атомы водорода участвуют в формировании органических молекул, а кислород уходит в атмосферу. Ячейка электролизера, разработанная Ф.Канаревым из Кубанского государственного аграрного университета, моделирует этот процесс.
Сходство с фотосинтезом заключается в том, что ячейка потребляет очень мало энергии. Фактически устройство использует напряжение всего в 0,062 В при силе тока 0,02 А. Ф.Канарев сконструировал две лабораторные модели электролизера: с коническими и цилиндрическими стальными электродами. По замыслу своего создателя, они моделируют годовые кольца ствола дерева. Даже при полном отсутствии электролита на электродах ячейки появляется разность потенциалов около 0,1В. После заливки раствора разность потенциалов возрастает. При этом положительный знак заряда всегда появляется на верхнем электроде, отрицательный — на нижнем. Ячейка низкоамперного электролизера представляет собой конденсатор. Вначале он заряжается при напряжении 1,5-2 В и силе тока, значительно большей 0,02 А, а затем постепенно разряжается под действием происходящих в нем электролитических процессов. И в это время устройство потребляет совсем немного энергии, которую тратит на подзарядку конденсатора. Даже в отключенном от сети приборе электролиз идет еще пять часов, о чем свидетельствует интенсивное бульканье пузырьков газа.
Обе модели электролизера, и с коническими, и с цилиндрическими электродами, работают с одинаковой энергетической эффективностью. Показатель этой эффективности еще предстоит уточнять. Но уже сейчас ясно, что затраты энергии на получение водорода из воды при низкоамперном электролизе уменьшаются в 12 раз, а по самым смелым подсчетам — почти в 2000 раз (т.е. составляют всего от 0,407 до 0,0023 кВт.ч на кубометр водорода). По мнению Ф.Канарева, предложенный им метод получения дешевого водорода из воды можно будет использовать для создания промышленных электролизеров, которые найдут применение в будущей водородной энергетике.
zn.ua
Разложение воды на водород и кислород
Существуют различные способы получения водорода и кислорода, которые условно можно разделить на промышленные и лабораторные.Один из наиболее простых и популярных методов получения и кислорода, и водорода – разложение воды на водород и кислород. Уравнение данной химической реакции имеет вид:
 .
.
Учитывая, что разложению подверглось 100 г воды, рассчитаем её количество вещества:
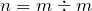 ;
;
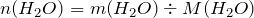 ;
;
 ;
;
 .
.
Согласно уравнению реакции, вода, водород и кислород находятся в следующих мольных соотношениях:
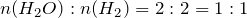 ;
;
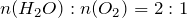 .
.
Это означает, что количество вещества продуктов реакции будет равно:
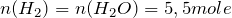 ;
;
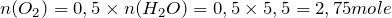 .
.
Тогда, объемы выделившихся в ходе реакции разложения воды газов будут равняться:
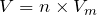 ;
;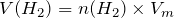 ;
;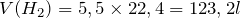 .
.
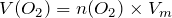 ;
;
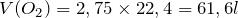 .
.
ru.solverbook.com
Обычная батарейка расщепляет воду на кислород и водород!
В отличие от традиционного топлива, которое выделяет вредные выхлопные газы, загрязняющие атмосферу и приводящие к изменению климатических условий, водородное топливо абсолютно безвредно для окружающей среды.
Почему все транспортные средства не используют водород в качестве топлива?

До сих пор экологически чистый процесс получения водорода требовал большого количества драгоценных металлов, что значительно повышает стоимость водородного топлива, особенно в сравнении с традиционным.
Путем химического взаимодействия атомов водорода с атомами кислорода, находящегося в воздухе, водородное топливо вырабатывает достаточно энергии для двигателя автомобиля, а «выхлопами» такого мотора становится чистая вода. Однако сегодня практически каждый «чистый» двигатель, который работает на водородном топливе, использует водород, полученный с помощью природного газа – процесс, экологическая чистота которого находится под сомнением.
Как получить «чистый» водород?
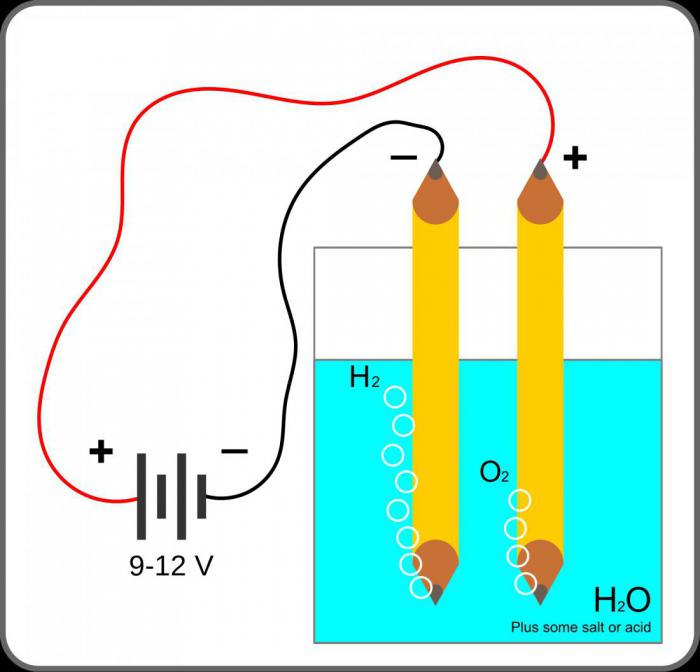
С помощью электрических потоков воду можно разделить на атомы кислорода и водорода. Этот процесс требует большого количества дорогих металлов, таких как платина или иридий, – они хорошо проводят электричество и не портятся, находясь в воде долгое время.

Процесс расщепления молекулы воды на атомы водорода и кислорода называется электролизом и проходит следующим образом: два электрода опускаются в воду, по ним проводится ток, под действием которого атомы водорода стремятся к отрицательно заряженному катоду, а атомы кислорода к положительно заряженному аноду.
Новый прорыв

Ученые из Стэндфордского университета провели уникальный эксперимент, в результате которого совершили процесс электролиза с помощью стандартных никелевых электродов под рекордно низким напряжением - обычная батарейка в 1.5 Вольт.
По данным ученых, конструкция электродов из никеля и его оксида позволила процессу успешно завершиться под таким низким напряжением. До этого никому не удавалось совершить подобное. Новая технология в промышленных масштабах поможет производителям водородного топлива значительно сэкономить на электричестве и проводниках. Сейчас ученые работают над тем, как увеличить продолжительность работы никелевых проводников в воде.
fb.ru
как разделить воду на водород и кислород
Получение водорода из воды постоянными магнитами
В разделе Техника на вопрос Можно ли отделить водород от кислорода, как это легко сделать? заданный автором Илья Самойлов лучший ответ это в смысле разложить воду?Электричеством!В раствор пищевой соды погружаем два электрода из графита или нержавейки, подключаем мощный источник постоянного тока. С минуса пойдет водород, с плюса кислород и углекислый газ.> есть смесь водорода и кислорода в газообразном состоянии как разделить эти два газа? возможно ли это и какой самый простой способ это сделать?сжечь это, и разложить образовавшуюся воду :))2 STYLEFLIPВы ЭТО пробовали на практике, или умных книжек начитались? Вам рассказать что будет если использовать соль (поваренную) и электроды из ЛЮБОГО металла? 🙂ЗЫ как разделить смесь газов. Через мембрану пропустить, у которой поры больше молекулы h3 и меньше молекулы O2.
Ответ от 2 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: Можно ли отделить водород от кислорода, как это легко сделать?
Ответ от Ђехнический директор[гуру]Это не легко.
Ответ от STYLEFLIP[активный]Смесь водорода и кислорода в газообразном состоянии это водяной парЭлектролиз - электрохимический процесс, при котором раствор (жидкость, электролит и т. д. ) по действием электрического тока распадаются на ионы (разлагается).В промышленности такой метод применяют для получения металлов и других веществ.Электролиз - энергоёмкий процесс. Нужно затратить немало энергозатрат на получение определенного вещества.Электролиз воды в домашних условиях.Для того чтобы провести электролиз воды домашних условиях, нужно подготовить оборудование. Итак, вам потребуется ёмкость, куда наливать воду, соль (служит для усиления проводящих способностей) , источник питания, два электрода (из любого металла). Порядок работы: в ёмкость наливают воду, к воде на четверть объёма емкости присыпают соль и перемешивают, в емкость опускают электроды, соединенные с источником питания (ток не менее 0.5А). При включении источника питания происходит вскипание раствора, о чем будут свидетельствовать пузырьки на одном из электродов. Это и будет электролиз воды в процессе. Продуктом электролиза будет водород и кислород.Так что электролиз может быть доступен не только производстве.Поваренная соль- гораздо более сильный электролит чем пищевая сода
Ответ от Картофельный папа[гуру]Водород отделяется от остальных газов с помощью диффузионных фильтров на основе палладиевой фольги.Ну, а вообще проще будет организовать электролиз воды так, чтоб смесь не образовывалась, и ее не требовалось разделять. Например, разделить объем (и электролит) электролизера проницаемой перегородкой, например, из брезента на анодную и катодную половины. В раздельных половинах газы не будут смешиваться.
Ответ от Иван Иванов[гуру]Сжать, кислород станет жидким при 180 атмосферах ( или около этого ) , а водород не сжижается. Снизу слил жидкий кислород и ВСЁ .
Ответ от Корпускуляр[гуру]Наиболее простой способ - центробежная сепарация. Берёте обыкновенную трубу и запускаете в неё смесь по касательной к боковой поверхности. Смесь будет крутиться и разделяться под действием центробежных сил: более тяжёлый кислород отжимается к периферии, более лёгкий водород собирается в центре. И если Вы теперь сделаете два отвода в противоположных торцах - один строго по центру, а другой впритык к боковой поверхности - то из первого пойдёт смесь обогащённая волородом, а из второго пойдт смесь, обогащённая кислородом. Но всё же будет идти смесь, а не чистые газы. Повторной сепарацией и увеличением скорости подачи в камеру можно добиться очень высокй степении разделения газов, но 100%-ная степень таким способом всё равно будет недостижима. Однако, здесь будет наблюдаться побочный процесс: водород будет выходить из камеры очень холодным, а кислород сильно горячим.А если надо добиться именно абсолютного разделения, здесь подойдут только селективные мембраны. Размер молекулы водорода намного меньше размера молекулы кислорода. И если подавать смесь под большим давлением на мембрану, диаметр пор которой превышает размер водородных молекул, но меньше размера кислородных, то просачиваться через неё будет исклчительно водород.
Ответ от Leonid[гуру]Физически - элементарно. Охладить до сжижения кислорода (примерно -180...-190). Водород при этой температуре останется в газообразном состоянии.Второй вариант - титановые насосы. Отожжёный титан впитывает водород как губка.Химически намного сложнее - учитывая реакционную способность кислорода. Почти всякий процесс с его участием идёт с выделением энергии, так что запросто рванёт. Можно попробовать порошок жёлеза в присутствии воды - оно будет ржаветь, связывая кислород. Но не быстро...
Ответ от Александра[активный]поваренная соль + вода + постоянный ток (электролиз) и вы надышитесь газ хлором
Ответ от 2 ответа[гуру]Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru











