Глобулярный белок: строение. Примеры глобулярных белков. Ферменты и антитела глобулярные белки
Глобулярные и фибриллярные белки. Типы фибриллярных белков
Человеческий организм вмещает больше пятидесяти тысяч белков, которые разнятся между собой по структуре, строению и функциям. Они состоят из разных аминокислот, каждая из них занимает свое положение в цепи полипептидов. На сегодняшний день не существует единой классификации, которая учитывает разные параметры белков. Одни из них отличаются по форме молекул, здесь выделяют глобулярные и фибриллярные белки, о них и пойдет сегодня речь.
Белки глобулярные
Сюда относятся белки такие, в чьих молекулах наблюдаются цепи полипептидов, что имеют шароподобную форму. Такое строение белка связано с гидрофильными (имеют соединения водорода с водой) и гидрофобными (отталкивают воду) взаимодействиями. К данному виду относятся экзимы, гормоны, которые имеют белковую природу, иммуноглобулины, протеиды, альбумины, а также белки, которые выполняют регуляторную и транспортную функции. Это большая часть белков человека.
Экзимы
Экзимы (ферменты) находятся во всех клетках, с их помощью одни вещества превращаются в иные, так как они резко изменяют скорость превращений, способствуя распаду, расщеплению и синтезу веществ из продуктов распада. Во всех протекающих в организме реакциях они играют роль катализатора, регулируют обмен веществ. Известно более пяти тысяч разных ферментов. Все они выполняют до нескольких миллионов действий в секунду. Но они способствуют ускорению определенных реакций, оказывая действие только на определенные вещества. Ферменты удаляют погибшие клетки, шлаки и яды. Они являются катализаторами всех процессов в организме, а если их недостаточно, то у человека увеличивается вес за счет накопления отходов в теле.
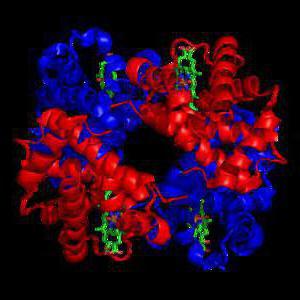
Иммуноглобулины
Антитела (иммуноглобулины) представляют собой соединения белков, что появляются вследствие ответной реакции на поступление в организм бактерий и вирусов, а также токсинов. Они не дают им размножаться и нейтрализуют отравляющие вещества. Иммуноглобулины распознают и связывают чужеродные вещества, их уничтожают, образуя иммунные комплексы, а потом удаляют эти комплексы. Также они защищают организм от повторного инфицирования, так как антитела против болезней, которые были перенесены, длительный период сохраняются. Иногда в организме вырабатываются аномальные антитела, что нападают на собственный организм. Происходит это чаще всего из-за наличия аутоиммунных болезней. Таким образом, глобулярные и фибриллярные белки выполняют незаменимые функции в организме человека, поддерживая его нормальную жизнедеятельность.
Гормоны белковой природы
Сюда относятся гормоны поджелудочной, паращитовидной желез и гипофиза (инсулин, глюкагон, СТГ, ТТГ и другие). Одни регулируют углеводный обмен, увеличивая и понижая уровень сахара в крови, другие стимулируют рост клеток и деятельность щитовидной железы, третьи проводят регуляцию половых желез. Таким образом, все они регулируют физиологические функции. Эта их работа сводится либо к ингибированию, либо к активации систем ферментов.
Белки фибриллярные
Фибриллярные белки те, что имеют структуру в виде нити. Они не растворяются в воде и имеют массу молекулы очень большую, структура которой высокорегуляторная, она приходит в устойчивое состояние благодаря взаимодействиям между разными цепями полипептидов. Эти цепи находятся синхронно друг для друга на одной плоскости и создают так называемые фибриллы. К фибриллярным белкам относятся: кератины (волосы и иные роговые покровы), эластин (сосуды и легкие), коллаген (сухожилия и хрящи). Эти все белки выполняют в организме структурную функцию. Также сюда входит миозин (мышечное сокращение) и фибрин (свертывание крови). Этот вид белков выполняет опорные функции, которые придают прочности тканям. Таким образом, все типы фибриллярных белков выполняют незаменимую роль в анатомии и физиологии. Из них образуются защитные покровы человека, также они принимают участие в создании опорных элементов, поскольку входят в состав соединительной ткани, хрящей, сухожилий, костей и глубоких кожных слоев. В воде они не растворяются.
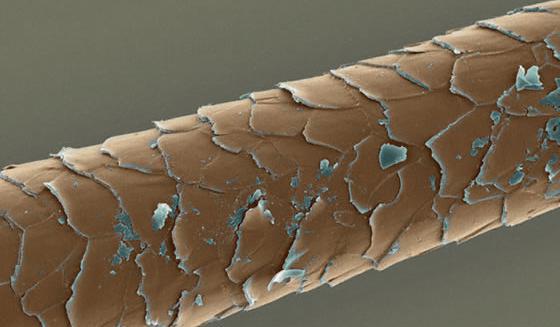
Кератины
К фибриллярным белкам относятся кератины (альфа и бета). Альфа-кератины представляют собой основную группу фибриллярных белков, из них формируются покровы, которые выполняют защитную функцию. Они представлены в сухом весе волос, ногтей, перьев, шерсти, панцирей и так далее. Разные белки имеют сходство в составе аминокислот, они содержат цистеин и имеют цепи полипептидов, которые располагаются одинаково. Бета-кератины содержат аланин и глицин, они входят в состав паутины и шелка. Таким образом, кератины бывают «твердыми» и «мягкими».
В ходе возникновения различий между эпителиальными клетками, в процессе развития особи, они ороговевают, в них приостанавливается обмен веществ, наступает угасание клетки и она ороговевает. Клетки кожи вмещают кератин, он совместно с коллагеном и эластином образует влагонепроницаемый слой эпидермиса, кожа становится упругой и прочной. При натирании и давлении клетки вырабатывают кератин в огромных количествах с защитной целью. Вследствие этого появляются мозоли или наросты. Ороговевшие клетки кожи начинают беспрерывно отшелушиваться и заменяются новыми. Таким образом, бета-кератины играет большую роль для животного мира, так как представляют собой основной компонент рогов и клювов. Альфа-кератины характерны для организма человека, они являются составной частью волос, кожи и ногтей, а также входят в костный скелет, определяя его крепость.
Коллаген
Фибриллярные белки, в частности коллаген с эластином, являются компонентами соединительной ткани, они составляют основную долю хрящей, стенок сосудов, сухожилий и прочего. Коллаген представлен у позвоночных третьей частью всей массы белков. Его молекулы производят полимеры, которые называются коллагеновыми фибриллами. Они очень прочны, выдерживают огромную нагрузку и не растягиваются. Коллаген состоит из глицина, пролина и аланина, в нем нет цистеина и триптофана, а тирозин и метионин присутствуют здесь в малом количестве.
Также большую роль в образовании фибрилл играют гидроксипролин и гидроксилизин. Изменения в строении коллагена приводят к развитию наследственных заболеваний. Коллагены очень прочны, они не растягиваются. Для каждой ткани присущи свои типы коллагенов. Этот белок выполняет множество функций:
- защитную, характеризующуюся обеспечением прочности тканей и их защитой от травм;
- опорную, обусловленную скреплением органов и формированием их форм;
- восстановительную, характеризующуюся регенерацией на клеточном уровне.
Также коллагены придают тканям эластичности, предотвращают развитие меланом кожи, участвуют в образовании оболочек клеток.
Эластин
Выше мы рассмотрели, какие белки относятся к фибриллярным. Еще сюда включают эластин, что имеет резиноподобные свойства. Его нити, которые находятся в легочной ткани, сосудистых стенках и связках, могут растягиваться во много раз больше своей обычной длины. После того, как нагрузка прекращает свое воздействие, они возвращаются в первичное положение. В составе эластина больше всего содержится пролина и лизина, гидроксилизина здесь нет. Таким образом, функции фибриллярных белков очевидны. Они играют большую роль в развития организма. Эластин обеспечивает растяжение и сжатие органов, артерий, сухожилий, кожи и прочего. Он помогает органам восстанавливать первоначальные размеры после растяжения. Если в организме человека недостает эластина, то у него образуются кардиоваскулярные изменения в виде аневризм, дефектов клапанов сердца и так далее.
Сравнение глобулярных и фибриллярных белков
Эти две группы белков разнятся между собой по форме молекул. Глобулярные белки имеют цепи полипептидов, что скручены очень плотно в овальные структуры. Фибриллярные белки имеют цепи полипептидов, которые находятся параллельно друг другу и образуют слой. По механическим свойствам ГБ не сжимаются и не распрямляются, а ФБ, наоборот, имеют такую способность. ГБ не растворяются в воде, а ФБ растворяются. Также эти белки разнятся по своим функциям. Первые выполняют функцию динамическую, а вторые – структурную. Глобулярные белки могут быть представлены в виде ферментов и антител, а также гемоглобина, инсулина и прочего. Примеры фибриллярных белков: коллаген, кератин, фиброин и прочие. Все эти виды белков незаменимы, недостаточное их количество в организме приводит к серьезным нарушениям и патологиям.
Таким образом, глобулярные и фибриллярные белки выполняют незаменимую роль в нормальной жизнедеятельности организма позвоночных. Они обеспечивают деятельность органов, тканей, кожи и прочего, выполняют множество функций, необходимых для полноценного развития организма.
fb.ru
1.9 Глобулярные и фибриллярные белки
20Глава 1 Аминокислоты и белки
3.Трехмерная структура многих олигомерных белков меняется, когда белок связывается с лигандами. Иными словами, третичная и четвертичная структура таких белков изменчива, и это — ключ к регуляции их активности.
4.У некоторых белков есть общие субъединицы. Это можно объяснить тем, что в ходе эволюции субъединицы образовывали новые комбинации и это более оправданно, чем создание нового мономерного белка с той же функцией.
5.Полисубъединичные белки могут катализировать несколько последовательных реакций, в которых продукт первой реакции становится субстратом для второй. Пример: ПДГ (пируватдегидрогеназный комплекс).
Белки разделяют на две группы по их общей морфологии: глобулярные ифибриллярные. Отличия между фибриллярными и глобулярными белками приведены в таблице ниже. Третичная структура глобулярных белков представляетглобулу (или клубок) и имеет сферическую или округлую форму. Третичная структура фибриллярных белков имеет форму узкойзакрученной нити.Кератин иколлаген — примеры фибриллярных белков.
Таблица 3 | Глобулярные и фибриллярные белки |
|
|
|
|
|
|
| Фибриллярные белки |
| Глобулярные белки |
|
|
|
|
Третичная | Представляет собой длинные, узкие | Имеет | округлую, сферическую |
структура | закрученные нити | форму |
|
|
|
| |
Растворимость | Нерастворимы | Отчасти растворимы (образуют кол- | |
|
| лоидные растворы) | |
|
|
| |
Примеры | Коллаген (кожа, кости, зубы, сухожи- | Гемоглобин (в эритроцитах), инсулин | |
| лия), кератин (волосы, ногти) | (гормон поджелудочной железы), | |
|
| каталаза (обеспечивает распад пе- | |
|
| роксида водорода в живых клетках) | |
|
|
| |
Структура | Коллаген существует в виде тройной | Выполняют различные функции в | |
и функции | спирали, механически стойкой и | клетках. Хорошо растворимы, по- | |
| прочной. Его содержание особенно | скольку | на поверхности белковой |
| высоко в сухожилиях, связках, соеди- | молекулы расположены преимуще- | |
| нительной ткани, мышцах, коже и | ственно полярные аминокислоты, а | |
| других тканях, испытывающих на | неполярные аминокислоты скрыты в | |
| себе сильное механическое воздей- | ядре белка. Полярные аминокис- | |
| ствие. | лоты участвуют в диполь-дипольных | |
|
| взаимодействиях с молекулами рас- | |
|
| творителя. | |
|
|
|
|
Глобулярные и фибриллярные белки 21
А Кератин
Кератин является механически прочным и химически неактивным белком. Он обнаружен у большинства позвоночных и представляет собой важный компонент внешнего эпидермального слоя и различных структур: волос, рогов, ногтей и перьев. Кератины классифицируют на 2 основные группы:α-кератины (у человека) иβ-ке- ратины (у птиц и рептилий). Геном человека содержит ~50 генов, кодирующих тканеспецифичные кератины.
Кератин имеет очень сложную структуру, отличающуюся от той, которую имеют глобулярные белки.
Первичная структура α -кератинаточно так же представляет собой цепочку аминокислотных остатков. Центральный сегмент каждой полипептидной цепиα-ке-ратина имеет псевдоповтор из 7 аминокислотных остатков:a-b-c-d-e-f-g.В позициях-a-и-d-чаще всего находятся гидрофобные аминокислотные остатки (см.Рис. 17 ). Поскольку на один витокα-спиралиприходится ~3,6 остатка, аминокислотные остатки-a-и-d-расположены всегда по одну сторону цепи. Это позволяет двум полипептидным цепям образовыватьдимеры (в рамках надвторичной структуры). Кроме того,α-кератинысодержат остатки цистеина, между которыми образуются прочныедисульфидные связи. Они стабилизируют общую структуру кератина, связывая между собой полипептидные цепи.
Вторичная структура α-кератинаочень похожа на обычнуюα-спираль,однако вα-кератинеона имеет меньший шаг (~5,1 Å), а значит, более плотную упаковку. Это вызвано тем, что вα-кератинедве полипептидные цепи оборачиваются относительно друг друга и формируютзакрученную нить, одновременно вызывая небольшие структурные изменения в цепях (см.Рис. 18 ▼).
Рис. 17. | Расположение гидрофобных | Рис. 18. | Закрученная нить кератина |
остатков -a-и-d-в цепях кератина. | (формируется из двух полипептидных це- | ||
|
| пей). | |
Более высокие уровни структурной организации кератина ещё не так хорошо изучены. В целом всю структуру α -кератинаможно представить следующим образом (включая высшие уровни структурной организации) (см.Рис. 19 ▼):
studfiles.net
,биохимия
Биохимия
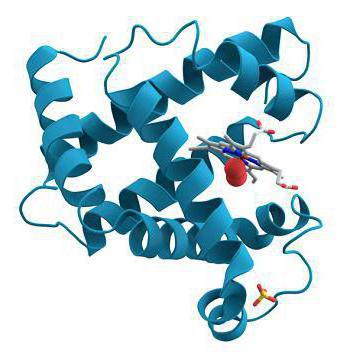
1)К глобулярнымотносят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков - рассмотренные выше миоглобин и гемоглобины.
Фибриллярныебелки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови.
Простые белки.Некоторые белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют"простые белки". Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд.
Сложные белки
Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют "сложные белки". Прочно связанная с белком небелковая часть носит название простетической группы.
Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины. В состав гемопротеинов, кроме уже рассмотренных выше белков гемоглобинов и миоглобина, входят ферменты - цитохромы, каталаза и пероксидаза. Гем, присоединённый к разным белковым структурам, выполняет в них характерные для каждого из белков функции (например, в составе гемоглобина переносит О2, а в составе цитохромов - электроны).
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют"холопротеин".
2) Классификация белков по функциям
Белки выполняют в клетках множество биологических функций. По признаку сходства выполняемых белками функций их можно разделить на следующие большие группы.
1. Ферменты
Ферменты - специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Так как ферменты, как и любые белки, имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы. В настоящее время известно около 2000 различных ферментов, ускоряющих различные химические реакции. Например, протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот - аргинина или лизина. Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклеотидами в полинуклеотидной цепи.
Благодаря набору ферментов в клетках превращения поступающих в них веществ протекают не хаотично, а в строго определённых направлениях.
2. Регуляторные белки
Крегуляторным белкам относят большую группу белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени. Например, гормон инсулин выделяется в кровь при повышении концентрации глюкозы в крови после еды и, стимулируя использование глюкозы клетками, снижает концентрацию глюкозы до нормы, т.е. восстанавливает гомеостаз.
Кроме того, к регуляторным относят белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию. Например, белок кальмодулин в комплексе с четырьмя ионами Са2+может присоединяться к некоторым ферментам, меняя их активность.
Регуляторные ДНК-связывающие белки, присоединяясь в определённые моменты к специфичным участкам ДНК, могут регулировать скорость считывания генетической информации (они описаны в разделе 4).
3. Рецепторные белки
Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.
4. Транспортные белки
Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, белок плазмы крови альбумин переносит жирные кислоты и билирубин (продукт распада тема), а гемоглобин эритроцитов участвует в переносе О2от лёгких к тканям. Стероидные гормоны переносятся в крови специфическими транспортными белками.
Транспортные белки участвуют также в переносе гидрофильных веществ через гидрофобные мембраны. Так как транспортные белки обладают свойством специфичности взаимодействия с лигандами, их набор в клеточной мембране определяет, какие гидрофильные молекулы могут пройти в данную клетку. С помощью белков-переносчиков в клетку проникают глюкоза, аминокислоты, ионы и другие молекулы.
5. Структурные белки
Некоторые белки, расположенные определённым образом в тканях, придают им форму, создают опору, определяют механические свойства данной ткани. Например, как уже говорилось выше, главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий высокую прочность. Другой структурный белок (эластин) благодаря своему уникальному строению обеспечивает определённым тканям свойство растягиваться во всех направлениях (сосуды, лёгкие).
6. Защитные белки
Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и уничтожается клетками иммунной системы.
Защитными свойствами обладают белки свёртывающей системы крови, например фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.
7. Сократительные белки
Некоторые белки при выполнении своих функций наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц. Другой пример таких белков - тубулин, из которого построены клеточные органеллы - микротрубочки. Микротрубочки в период деления клетки регулируют расхождение хроматид. Микротрубочки - важные элементы ресничек и жгутиков, с помощью которых клетки передвигаются.
Однако существует большое количество белков, имеющих уникальные функции, которые не вошли в эту довольно простую классификацию.
3) Cемейства родственных белков
В ходе эволюции в пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Гомологичными называют последовательности, имеющие много сходных черт. Они содержат во многих положениях одни и те же аминокислоты, называемые инвариантными, а в некоторых положениях могут находиться разные, но близкие по физико-химическим свойствам аминокислотные остатки.
Эти белки имеют поразительно схожие конформации: количество и взаиморасположение α-спиралей и/или β-структур, большинство поворотов и изгибов полипептидных цепей сходно или идентично. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков.
. Семейство сериновых протеаз
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах).
Для всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102(эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты (рис. 1-44). Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами.
Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами.
Рис. 1-44. Пространственные структуры эластазы (А) и химотрипсина (Б).
Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов. В процессе активации нативных белков сериновые протеазы гидролизуют одну или две особенные пептидные связи из сотен связей, имеющихся в белковом субстрате. Это связано с тем, что в нативном белке фермент узнаёт не только аминокислоты, непосредственно формирующие пептидную связь, но и некоторые аминокислотные остатки, окружающие связь, подвергающуюся ферментативному гидролизу.
. Семейство иммуноглобулинов
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами
в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107видов иммуноглобулинов.
Все иммуноглобулины характеризуются общим планом строения, который мы рассмотрим на примере строения IgG.
Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ,light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ.heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG относят к мономерам.
Лёгкие цепи IgG состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена (рис. 1-45).
Тяжёлые цепи IgG имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, Сh4). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей Сh2, и СН2есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость.
Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют"биваленты". В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных доменов обеих цепей, а всего лишь 20-30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальные способности каждого клона антител
Рис. 1-45. Строение иммуноглобулина G.
взаимодействовать с соответствующим (комплементарным) антигеном.
Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител.
5)Классы иммуноглобулинов. Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ξ, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A, D, Е, G и М. Особенности строения тяжёлых цепей придают их "шарнирным участкам" и С-концевым областям характерную для каждого класса конформацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками).
Иммуноглобулины М - первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами в кровь.
Мембранно-с вязанная форма иммуноглобулинов М . Созревающие В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-концевой ("хвостовой") области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков.
Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител.
Секреторная форма иммуноглобулинов М . Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1-46).
В тяжёлых цепях их мономеров отсутствует гидрофобная "хвостовая" часть. Пентамерная молекула содержит 10 участков связывания с антигеном, что облегчает вероятность прикрепления Неизвестного ранее антигена к иммуноглобулину (рис. 1-47).
Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его "хвостовой" области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм.
У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgGg1а в наименьшем -
Рис. 1-46. Строение пентамерной секреторной молекулы иммуноглобулина М.
Рис. 1-48. Фагоцитоз комплекса антиген-антитело нейтрофилом. А - взаимодействие бактерии, покрытой IgG, с рецепторами нейтрофилов; Б - поглощение бактерии нейтрофилом; В - переваривание бактерии внутри фагосомы нейтрофила.
IgGg4). Степень гомологии между этими подклассами очень высока (около 90-95%).
IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. Конформационные изменения в "хвостовой" области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-концевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах (рис. 1-48).
IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J (рис. 1-49).
На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство (рис. 1-50).
Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE
Мономер Рис. 1-49. Строение димерной молекулы иммуноглобулина А.
Рис. 1-50. Транспорт иммуноглобулинов А через эпителиальные клетки в протоки желёз.
связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток (рис. 1-51).
После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций.
Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.
Рис. 1-51. Выброс биологически активных веществ тучной клеткой в результате присоединения антигена к фиксированным на её поверхности IgE.
4)Электрофорезявляется единственным надежным способом обнаружения парапротеинов в биологических жидкостях, а также является первичной процедурой отбора. Это информативный клинический метод для обнаружения изменений сывороточных белков, связанных с определенными заболеваниями. Изменения по сравнению с нормальной структурой белка сыворотки, ( наличие дополнительных компонентов (моноклональные полос), увеличение / уменьшение нормального содержания компонентов, предупреждает врача о необходимости проведения дополнительного анализа белков. Методом электрофореза возможно определить различные виды белка в сыворотке крови. Отдельные белки, за исключением альбумина, обычно не определяются методом электрофореза. Однако, измеряются белковые фракции или группы (Альбумин, alfa1-alfa2-бетта-гамма-глобулин). Уровни белковых фракций можно определить путем измерения общего белка сыворотки крови и умножить на относительный процент от каждой доли белкового компонента, или автоматически с применением аппарата HellabioScan. Электрофоре сыворотки всегда должен сопровождаться измерением сывороточных IgG, IgA и IgM концентраций. Образцы с повышенным содержанием IgA и IgM , которые не могут быть интерпретированы, как поликлональные согласно шаблону электрофореза, должны быть проанализированы дополнительно, чтобы исключить иммунофиксацию небольшими группами парапротеинов и закрытие одной из нормальной зон.
Электрофорез белков помогает выявить заболевания печени и почек, иммунной системы, некоторые злокачественные новообразования (лейкозы), острые и хронические инфекции, генетические поломки и др. Известен ряд своеобразных электрофоретических "синдромов" – типичных картин электрофореграмм, характерных для некоторых патологических состояний.
Среди них можно отметить: 1. Острое воспалениес активацией системы комплемента и увеличением синтеза острофазных белков (a1-антитрипсина, гаптоглобина, фибриногена и др.). Оно проявляется увеличением доли a1- и a2-глобулинов и может быть подтверждено измерением СОЭ, исследованием концентрации С-реактивного белка, фибриногена (в динамике) и других острофазных белков.
2. Хроническое воспалениес усилением синтеза ряда острофазных белков, а также иммуноглобулинов; проявляется умеренным возрастанием a2- и b-глобулинов, повышением g-глобулинов и некоторым снижением альбумина. Подобные отклонения могут наблюдаться при хронических инфекциях, коллагенозах, аллергии, аутоиммунных процессах и при малигнизации.
3. Тяжелые заболевания печенисопровождаются снижением синтеза альбумина и a глобулинов, что и отражается на электрофореграммах. Как указывалось выше, нужно помнить, что процентная концентрация альбумина может оказаться сниженной лишь относительно, из-за накопления других белков, поэтому оценивать нарушения белково-синтезирующей функции печени следует по абсолютному содержанию альбумина (в г/л). При хронических гепатитах и циррозах печени возрастает как относительное, так и абсолютное количество g-глобулинов (b- и g-фракции могут сливаться из-за накопления IgA), причем превышение g-глобулинов над альбуминами является весьма неблагоприятным прогностическим признаком.
4. Нефротический синдром сопровождается увеличением фильтрации белков в почках и селективной протеинурией – потерей с мочой большого количества альбумина и части низкомолекулярных глобулинов (a1-антитрипсина, трансферрина). При этом в печени усиливается синтез более крупных протеинов семейства a2-глобулинов (макроглобулин, апо-В), которые накапливаются в крови и формируют картину со значительным снижением альбумина и повышением a2-глобулинов.
5. Нарушение всасывания или значительная потеря белковвозможна как при нефротическом синдроме, так и при массивных ожогах, синдроме Лаэлла, патологии желудочно-кишечного тракта и т.д. В последнем случае снижается абсолютное содержание общего белка и особенно альбумина, а на протеинограмме оказывается уменьшенной доля альбумина при относительно равномерном возрастании всех глобулинов. Введение белковых препаратов (иммуноглобулины, альбумин или плазма крови) в ходе лечения больных немедленно отражается на электрофоретической картине, что позволяет следить за динамикой потерь или выведения поступивших белков. 6.Тяжелый иммунодефицитврожденного или приобретенного генеза обычно сопровождается выраженным снижением g-глобулиновой фракции. При этом желательно провести дополнительное количественное определение IgG, IgA и IgM.
7. Парапротеинемияпри злокачественных и доброкачественных процессах – симптом, для выявления которого именно электрофорез является методом выбора. При накоплении в крови моноклональных иммуноглобулинов или фрагментов их цепей, как бывает, в частности, при миеломной болезни и некоторых лейкозах, на протеинограмме появляется более или менее острый пик в области от a2- до g-глобулинов (так называемый М градиент), хорошо заметный визуально. Электрофорез белков мочи, проведенный параллельно, в этом случае выявит пик, находящийся в той же области. Для дифференцировки парапротеинов и идентификации белковых цепей можно использовать современнейшую модификацию электрофореза – иммунофиксацию, для которой выпускаются специальные гелевые пластины с антисыворотками.
Белки сыворотки разделяют методом электрофореза на альбумины и глобулины.Альбумин- представляет наибольшую белковую фракцию сыворотки крови человека. Концентрация альбумина отражает протеиновый статус крови и внутренних органов. Главная цель альбумина крови поддерживать коллоидное осмотическое давление, которое держит жидкость в пределах васкулярного пространства. Именно поэтому у пациентов с очень истощенным альбуминовым уровнем могут развиться отек, асциты, легочные отеки.Глобулиныусловно разделяют на альфа-1, альфа-2-, бета-(β1 и β2), и гамма глобулины. Они могут быть разделены и количественно в лаборатории методом электрофореза.Альфа-1 фракция включаетв себя долю альфа-1 анти-трипсин и тироксинсвязывающий глобулин.Альфа-2 фракция содержит гаптоглобин, церулоплазмин, HDL-и альфа-2-макроглобулин. Как правило, увеличения показателей альфа-1 и альфа-2 является признаком воспаления.Бета долювключает трансферрин, комплемент и бета-липопротеиды.Долю гамма включает в себя различные типы антител (иммуноглобулины М, G, А, D,E ).Нормальная и патологическая концентрация белков.Всего белков в сыворотке крови человека:
studfiles.net
1.9 Глобулярные и фибриллярные белки
20Глава 1 Аминокислоты и белки
3.Трехмерная структура многих олигомерных белков меняется, когда белок связывается с лигандами. Иными словами, третичная и четвертичная структура таких белков изменчива, и это — ключ к регуляции их активности.
4.У некоторых белков есть общие субъединицы. Это можно объяснить тем, что в ходе эволюции субъединицы образовывали новые комбинации и это более оправданно, чем создание нового мономерного белка с той же функцией.
5.Полисубъединичные белки могут катализировать несколько последовательных реакций, в которых продукт первой реакции становится субстратом для второй. Пример: ПДГ (пируватдегидрогеназный комплекс).
Белки разделяют на две группы по их общей морфологии: глобулярные ифибриллярные. Отличия между фибриллярными и глобулярными белками приведены в таблице ниже. Третичная структура глобулярных белков представляетглобулу (или клубок) и имеет сферическую или округлую форму. Третичная структура фибриллярных белков имеет форму узкойзакрученной нити.Кератин иколлаген — примеры фибриллярных белков.
Таблица 3 | Глобулярные и фибриллярные белки |
|
|
|
|
| Фибриллярные белки | Глобулярные белки |
|
|
|
Третичная | Представляет собой длинные, узкие | Имеет округлую, сферическую |
структура | закрученные нити | форму |
|
|
|
Растворимость | Нерастворимы | Отчасти растворимы (образуют кол- |
|
| лоидные растворы) |
|
|
|
Примеры | Коллаген (кожа, кости, зубы, сухожи- | Гемоглобин (в эритроцитах), инсу- |
| лия), кератин (волосы, ногти) | лин (гормон поджелудочной же- |
|
| лезы), каталаза (обеспечивает рас- |
|
| пад пероксида водорода в живых |
|
| клетках) |
|
|
|
Структура | Коллаген существует в виде тройной |
и функции | спирали, механически стойкой и |
| прочной. Его содержание особенно |
| высоко в сухожилиях, связках, со- |
| единительной ткани, мышцах, коже и |
| других тканях, испытывающих на |
| себе сильное механическое воздей- |
| ствие. |
|
|
Выполняют различные функции в клетках. Хорошо растворимы, поскольку на поверхности белковой молекулы расположены преимущественно полярные аминокислоты, а неполярные аминокислоты скрыты в ядре белка. Полярные аминокислоты участвуют в диполь-дипольныхвзаимодействиях с молекулами растворителя.
Глобулярные и фибриллярные белки 21
А Кератин
Кератин является механически прочным и химически неактивным белком. Он обнаружен у большинства позвоночных и представляет собой важный компонент внешнего эпидермального слоя и различных структур: волос, рогов, ногтей и перьев. Кератины классифицируют на 2 основные группы:α-кератины (у человека) иβ-ке- ратины (у птиц и рептилий). Геном человека содержит ~50 генов, кодирующих тканеспецифичные кератины.
Кератин имеет очень сложную структуру, отличающуюся от той, которую имеют глобулярные белки.
Первичная структура α -кератинаточно так же представляет собой цепочку аминокислотных остатков. Центральный сегмент каждой полипептидной цепиα-ке-ратина имеет псевдоповтор из 7 аминокислотных остатков:a-b-c-d-e-f-g.В позициях-a-и-d-чаще всего находятся гидрофобные аминокислотные остатки (см.Рис. 17 ). Поскольку на один витокα-спиралиприходится ~3,6 остатка, аминокислотные остатки-a-и-d-расположены всегда по одну сторону цепи. Это позволяет двум полипептидным цепям образовыватьдимеры (в рамках надвторичной структуры). Кроме того,α-кератинысодержат остатки цистеина, между которыми образуются прочныедисульфидные связи. Они стабилизируют общую структуру кератина, связывая между собой полипептидные цепи.
Вторичная структура α-кератинаочень похожа на обычнуюα-спираль,однако вα-кератинеона имеет меньший шаг (~5,1 Å), а значит, более плотную упаковку. Это вызвано тем, что вα-кератинедве полипептидные цепи оборачиваются относительно друг друга и формируютзакрученную нить, одновременно вызывая небольшие структурные изменения в цепях (см.Рис. 18 ▼).
Рис. 17. | Расположение гидрофобных | Рис. 18. | Закрученная нить кератина |
остатков -a-и-d-в цепях кератина. | (формируется из двух полипептидных це- | ||
|
| пей). | |
Более высокие уровни структурной организации кератина ещё не так хорошо изучены. В целом всю структуру α-кератинаможно представить следующим образом (включая высшие уровни структурной организации) (см.Рис. 19 ▼):
studfiles.net
строение. Примеры глобулярных белков :: SYL.ru
Для возникновения простейшей биологической системы в условиях нашей планеты достаточно присутствия всего двух видов органических веществ: нуклеиновых кислот и белков. Структура этих соединений имеет как черты сходства, так и кардинальные различия. Например, они являются биополимерами, находятся во всех без исключения клетках живых организмов. Соединения под действием негативных факторов могут изменять свою нативную структуру - подвергаться денатурации и деструкции. В нашей статье мы рассмотрим, какую роль выполняют белки в молекулах сложных веществ, например, таких как гликопротеиды и липопротеиды. Также изучим особенности строения глобулярных белков и приведем примеры различных их видов.
Строение пептидов
Гигантские размеры белков (по сравнению с величиной других клеточных органических соединений - углеводов, жиров, витаминов и т. д.) объясняются их строением. Все белки, иначе называемые протеинами, представляют собой сложные комплексы – полимеры. Они имеют не только большую молекулярную массу, но и несколько форм пространственного расположения собственной макромолекулы. Элементарные частицы белкового полимера – это 20 видов аминокислот, участвующих в реакции поликонденсации. Они соединяются между собой посредством пептидных связей -CO—NH-, благодаря которым и образуется простейшая форма макромолекулы. Такая структура белков носит название первичной или линейной конфигурации. Образование дополнительных, сначала водородных связей, а затем и дисульфидных мостиков приводит к появлению спиральной и глобулярной форм белка. Третичная конфигурация в форме сферических молекул – глобул– распространена в живых биосистемах: клетках, органах, тканях. Она может усложняться в виде нескольких глобул, связанных небелковым компонентом, и образовывать высшую форму организации – четвертичную структуру.
Гемоглобин
В систему жидких сред организма входит кровь. Ее главная функция – это транспорт различных соединений. Кроме питательных веществ, например глюкозы, содержащейся в кровяной плазме, к клеткам поступает кислород, а удаляется из них углекислый газ. Молекулы O2 соединяются со специальным белком – гемоглобином – и далее, в связанном состоянии, разносятся к клеткам. Кислород необходим им для процесса дыхания, которое заключается в окислении органических веществ. Гемоглобин представляет собой глобулярный белок, который состоит из четырех аминокислотных цепей. Они удерживаются вместе благодаря небелковому компоненту, который называется гемом и содержит ион железа. Комплекс кислорода и протеина называется оксигемоглобином. В процессах метаболизма в клетках образуется побочный продукт распада – углекислый газ. Его молекулы также способны соединяться с гемоглобином, образуя карбоксигемоглобин. Углекислый газ поступает в органы дыхания и путем диффузии, затем удаляется из организма во время выдоха.
Свойства глобулярных белков
В основе гуморального вида иммунитета лежит способность специфических белков к выполнению функции защиты клеток, органов и тканей от повреждающего действия патогенной микрофлоры и микрофауны: вирусов, бактерий, простейших, грибков и т. д. Глобулярные белки-антитела взаимодействуют как с самими возбудителями, так и с их токсинами по принципу "ключ – замок". Антитела включаются в обмен веществ бактерии или вируса и блокируют его. Чем выше сродство защитных протеинов и их специфичность, тем быстрее антитела уничтожают патогенные факторы. Человечество успешно борется с такими тяжелыми заболеваниями, как столбняк, корь или дифтерия, вводя здоровым людям, побывавшим в контакте с заболевшими, уже готовые антитела в виде сывороток. Эти вещества получают из крови предварительно зараженных животных: свиней, коров или обезьян, содержащей антитела. Сыворотка имеет в своем составе необходимый защитный глобулярный белок и помогает предотвратить заражение или облегчить протекание уже начавшейся болезни.
Ферменты
Химические реакции в клетках, в отличие от аналогично проведенных в лаборатории или происходящих в природе, протекают очень быстро. Объясняется это участием в них особых веществ – энзимов или ферментов. Биологический активатор скорости определенной реакции процесса обмена веществ – это глобулярный белок, имеющий сложное строение. В его составе есть специфическое образование – активный центр, связывающийся с субстратом реакции. Он и влияет на скорость процесса, происходящего с веществом. Все ферменты специфичны и влияют только на определенный химический процесс.
Классификация
Протеины, имеющие шаровидную форму молекулы и влияющие на протекание реакций ассимиляции и диссимиляции, можно разделить на несколько видов. Критериями будут типы реакции, форма и локализация фермента в клетке. К глобулярным белкам относится класс ферментов: пепсин, амилаза, глутаминсинтетаза, синтаза жирных кислот и т. д. Приведем несколько примеров.
Виды и функции глобулярных протеинов
Пепсин осуществляет расщепление пищевых белков в желудке в процессе энергетического обмена. Он синтезируется слизистым слоем желудочных клеток, состоящим из железистого эпителия. Амилаза, в отличие от пепсина, содержится не только в организме человека или животных, но и у растений. У них фермент образуется в момент прорастания семени, синтезируясь в летках зародыша. Он и ускоряет расщепление крахмала до глюкозы, необходимой для прорастания семени. У млекопитающих амилаза входит в состав панкреатического сока и расщепляет сложные углеводы. Синтаза жирных кислот – это крупный фермент цитоплазмы, обеспечивающий синтез жиров и высших жирных кислот.
В нашей статье мы изучили строение и свойства глобулярных белков.
www.syl.ru
Ферменты и другие глобулярные белки
Ферменты н другие глобулярные белки [c.443]Миоглобин является в каком-то смысле исключительным белком, поскольку у большинства других глобулярных белков содержание а-спи-ральных участков оказывается сравнительно невысоким. Например, составленная из 129 остатков цепь лизоцима (рис. 2-9), одного из самых небольших ферментов (мол. вес 14 600), содержит лишь несколько коротких спиралей. Цепь лизоцима уложена по большей части сложным и нерегулярным образом. Обратите внимание на область, содержащую антипараллельный складчатый р-слой. Он начинается с участка между остатками 42 и 45, далее цепь поворачивает назад, формируя петлю наподобие шпильки, и между остатками 51—54 и 42—45 образуются водородные связи. Складчатая структура просматривается и в некоторых других частях цепи. [c.96]
В белке волос и шерсти, а также других кератинах а-спирали многократно скручены друг с другом в многожильные тяжи, которые образуют видимые глазом нити. Цепи белков шелка вытянуты во всю длину (а не свернуты в спираль) и соединены с параллельными цепями водородными связями в листы, показанные на рис. 21-2,а. В глобулярных белках цепи не являются полностью вытянутыми или полностью свернутыми в а-спираль чтобы молекула имела компактную структуру, она должна быть надлежащим образом деформирована. В молекуле миоглобина (см. рис. 20-25) 153 аминокислоты белковой цепи свернуты в восемь витков а-спирали (обозначенные на рисунке буквами А-Н), которые в свою очередь свернуты так, что в результате получается компактная молекула. Витки Е и Р образуют карман, в котором помещается группа гема, и молекула кислорода может связываться с атомом железа этого гема. Подобным же образом построена молекула гемоглобина, которая состоит из четырех миоглобиновых единиц (см. рис. 20-26). Небольшой белок цитохром с (см. рис. 20-23) имеет меньше места для витков а-спирали. 103 аминокислоты этого белка свернуты вокруг его группы гема подобно кокону, оставляя к ней доступ только в одном месте. У более крупных ферментов, например трипсина (223 аминокислоты) и карбоксипептидазы (307 аминокислот) в центре молекулы имеются области, где белковая цепь делает ряд зигзагов, образуя несколько параллельных нитей, скрепленных водородными связями подобно тому, как это имеет место в молекуле шелка. [c.317]Белки-это полимеры аминокислот. Фибриллярные белки являются основным структурным материалом волос, кожи, ногтей, мышц и сухожилий. В этих структурах белковые цепи свернуты спиралями в многожильные тяжи или связаны друг с другом водородными связями в листы. Глобулярные белки включают ферменты, молекулы-переносчики и антитела. В белках этого типа цепи могут иметь вид спиралей или листов, но затем эти структуры многократно перегибаются, сворачиваясь в компактные, изолированные молекулы. [c.338]
Наиболее важный класс глобулярных белков образуют биологические катализаторы, ферменты. Они характеризуются каталитическим механизмом, позволяющим им ускорять достижение конкретной реакцией состояния термодинамического равновесия, а также специфичность к субстрату, благодаря которой они способны делать выбор между потенциальными молекулами субстратов, воздействуя на одни из них и отказываясь воздействовать на другие. Участок поверхности фермента, на котором происходит катализ, называется активным центром. Механизм катализа может осуществляться при помощи заряженных групп, доноров и акцепторов электрона или протона, а также при помощи атомов металла в активном центре фермента. Избирательность ферментов обусловливается формой их поверхности и характером взаимодействия с субстратом, например водородной связью, электростатическим взаимодействием или гидрофобным притяжением. Фермент и его субстрат соответствуют друг другу по форме и размеру, как ключ и замок. [c.339]
Характерная особенность структуры мицелл — это гидрофобное ядро, образованное углеводородными цепями молекул ПАВ, окруженное гидрофильным слоем их головных групп. Этим создается некоторое подобие мицеллярной структуры со структурой глобулярных белков (см. гл. I). Однако если белковая глобула — это относительно жесткое и весьма неоднородное образование, то мицелла ПАВ, напротив, носит псевдожидкий характер [1001 и образована совершенно идентичными молекулами ПАВ. Хотя эти различия и накладывают существенные ограничения на использование мицелл как моделей ферментов [1011, с другой стороны, именно благодаря простоте в построении мицелл в мицеллярных системах наиболее четко и достоверно могут быть прослежены такие эффекты, как стабилизация переходного состояния химической реакции за счет дополнительных сорбционных взаимодействий (или же сближение реагентов при их концентрировании), далее сдвиг р/Са реагирующих групп и влияние микросреды на скорость реакции. [c.115]
Функциональный аппарат клеток состоит в основном из ферментов. Сотни ферментов удалось выделить из живых клеток, очистить и получить в кристаллическом виде. Многие другие обнаруживаются только по их каталитическому действию и в чистом виде пока не выделены. Большинство известных в настоящее время ферментов представляет собой растворимые глобулярные белки, однако каталитическими свойствами могут обладать и структурные белки клетки. Так, актин и миозин совместно катализируют гидролиз АТР (гл. 4, разд. Е). (Следует, однако, заметить, что пока неясно, как эта ферментативная реакция сопряжена с сокращением мышечных волокон.) [c.5]
В более общем случае, когда полипептид построен путем ступенчатого наращивания различных остатков аминокислот, влияние различия структуры боковых радикалов обычно сильнее, чем тенденция к принятию упорядоченной конформации, возникающей из-за структурной регулярности скелета молекулы. В общем случае молекула принимает случайную или неупорядоченную конформацию. Это справедливо и для глобулярных белков, включая ферменты, где молекула в целом не принимает упорядоченной конформации, но тем не менее отдельные участки полипептидной цепи имеют упорядоченную конформацию там, где комплементарные боковые радикалы группируются друг с другом. [c.426]
Активность ферментов со временем исчезает, подобно активности простых катализаторов (кислот, оснований, ионов), и, как правило, она существует в течение меньшего промежутка времени, чем активности гетерогенных катализаторов (окиси алюминия или восстановленного никеля). В случае ферментативных реакций количество субстрата, превращенного в единицу времени, со временем становится все меньше, а спустя более длинный промежуток времени реакция практически приостанавливается. Дезактивация ферментов объясняется их денатурацией или другими превращениями, обусловленными их характером глобулярных белков. [c.794]
Несмотря на то что использованные методы были весьма различными, полученные результаты, в общем, довольно хорошо согласуются между собой (для одного и того же белка). Установлено, что молекулярные веса различных протеинов колеблются от 6000—12 ООО до нескольких миллионов и даже до десятков миллионов, чаще всего от 20 000 до 90 000. Форма макромолекул найдена весьма различной от частиц почти шарообразных, лишь несколько удлиненных, до вытянутых, нитевидных. В первом случае говорят о глобулярных белках, во втором — о фибриллярных. Большинство ферментов и других специфически активных протеинов представляет собой глобулярные белки. Обычно, характеризуя форму белковых частиц и степень их асимметрии, условно пользуются представлением о гидродинамически эквивалентном эллипсоиде, приближенно принимаемом за форму молекулы белка. При этом указывают величину отношения размеров его полуосей — s/a. Здесь в — продольная и а — поперечная полуоси. Величина е/а колеблется у различных белков примерно от 1 до 200. У глобулярных белков (в том числе ферментов) она обычно составляет от 1—2 до 4—6. Следует отметить, что истинные формы белковых молекул далеко не ясны и поэтому величины подобного рода имеют в определенной мере условный характер. [c.31]
Уже давно известно, что некоторые ферменты имеют каталитически активные простетические группы. Активность этих ферментов, однако, также зависит от их белковых компонентов об этом свидетельствует резкое падение их ферментативной активности при нагревании или под действием других факторов, ведущих к денатурации белка. Некоторые ферменты (например, рибонуклеаза) относительно устойчивы к нагреванию. Это обусловлено тем, что их белковый компонент лишь с трудом подвергается денатурации [4]. Поскольку большинство глобулярных белков легко денатурируется, термостабильность рибонуклеазы и некоторых других подобных ферментов указывает на то, что структура их белков более устойчива и жестка, чем структура обычных глобулярных белков. Иногда очень трудно [c.273]
Поверхности, для которых выполняется это соотношение, имеют минимальную площадь. С молекулярной точки зрения стремление поверхности к сокращению основано на том, что силы притяжения между молекулами, находящимися внутри фазы, и молекулами, расположенными на поверхности, превышают силы притяжения между молекулами, находящимися внутри фазы. Когда речь идет о поверхности жидкости, граница раздела между жидкостью и воздухом выражена достаточно резко и состоит из слоя толщиной в одну-две молекулы. Поверхность молекулы глобулярного белка гораздо сложнее, она очень неровная и содержит разного рода выступы и выемки независимо от того, насколько компактно молекула свернута в трехмерную глобулу. Поверхность белка не может быть гомогенной, и особенно сложной она бывает в случае ферментов, для которых характерно наличие одного или двух активных центров. Мы ограничимся описанием поведения модельных молекул с однородной поверхностью в надежде на то, что поведение молекул глобулярных белков во многом ему подобно. Обычно в качестве модели выбирают сферу. Если речь идет о вытянутых спиральных структурах, то моделью могут служить длинные тонкие стержни, но, как правило, удобнее использовать в качестве модели вытянутый эллипсоид. Сферу или эллипсоид гораздо легче описать с помощью математических уравнений, чем другие возможные модели. [c.381]
Советские ученые исследуют белковые вещества также с других теоретических позиций и другими методами. Д. Л. Талмуд на основании физикохимических исследований с использованием моделирования сделал интересную попытку построения новой модели глобулярных белков [291]. Биохимическое значение имеют работы В. Н. Ореховича [292] по кристаллическим белкам. Большой интерес представляют работы С. Е. Бреслера [293] с сотрудниками по так называемому ресинтезу белков под высоким давлением (5000—10000 атм.) и с участием ферментов, когда из продуктов распада белков получаются вещества, очень близкие по свойствам и составу к природным белкам. ]Иожно с уверенностью отметить, что все эти работы знаменуют собой новый этап в решении проблемы о строении и синтезе белков. [c.269]
Удивительно полная аналогия обнаруживается при сравнении структуры и свойств мицелл и глобулярных белков, включая ферменты. Рентгенографические исследования показали, что в глобулярных белках гидрофобные боковые цепи аминокислот обращены внутрь глобулы, в то время как заряженные и другие гидрофильные группы локализуются на поверхности, [c.309]
Явление, описанное выше на примере рибонуклеазы, кажется типичным для поведения глобулярных белков в целом. Вытянутые полипептидные цепи, по-видимому, наделены способностью при соответствующих условиях самопроизвольно принимать уникальную третичную структуру. В некоторых случаях в образовании активного белка принимают участие две или более полипептидных цепей, по даже и тогда денатурация, включающая в себя физическое разделение слагаемых цепей, в основном может быть обратима. Две различные полипептидные цепи инсулина рис. 45, б) соединены двумя дисульфидными связями, которые могут быть восстановлены с разделением цепей Атл В. При окислении раствора, содержащего смесь двух этих цепей, восстанавливается значительное количество активного гормона, идентичного с первоначальным белком [404]. Три субъединицы фермента альдолазы связаны лишь вторичными валентными связями. Эти субъединицы могут быть отделены друг от друга, развернуты в сильно вытянутую форму, а весь процесс может быть обратимым с сохранением активности фермента [405]. Образование третичной структуры в субъединицах, очевидно, приводит к появлению частиц с комплементарными поверхностями, что, таким образом, чрезвычайно благоприятствует их ассоциации в четвертичную структуру. [c.139]
Рентгеноструктурный анализ окси- и дезоксигемоглобинов позволил ответить на два очень важных вопроса, представляющих общий интерес для понимания свойств ферментов. Речь идет о том, почему простетические группы в глобулярных белках обладают совсем другими химическими свойствами, чем в растворе, и каким образом в белках осуществляется регуляция энергии связи субстрата (здесь — Ог) с активным центром. Изложенное позволило дать физически ясное обоснование давним представлениям энзимологов о роли стерических факторов в активных центрах белков. В данном примере речь идет [c.106]
Все белки являются полимерами аминокислот. Общая формула такого полимера показана в нижней части рис. 21-1, а модель отдельной аминокислоты-на рис. 21-12. Ферменты представляют собой один из классов белков, причем, видимо, наиболее важный. Ферменты имеют компактные молекулы с молекулярной массой от 10000 до нескольких миллионов и диаметром от 20 А и выше. Они выполняют роль катализаторов, регули-руюидах биохимические реакции. Другие компактные молекулы белков, например миоглобин и гемоглобин, выполняют роль переносчиков и накопителей молекулярного кислорода (см. рис. 20-25, 20-26). Цитохромы-это белки, способные к окислительно-восстановительным реакциям и играющие роль промежуточных звеньев при извлечении энергии из пищевых продуктов (см. рис. 20-23). Молекулы гамма-глобулинов с молекулярной массой порядка 160000 представляют собой так называемые антитела, защитное действие которых заключается в том, что они присоединяются к вирусам, бактериям и другим чужеродным телам в живом организме и осаждают их из жидких сред. Все перечисленные белки относятся к глобулярным белкам. [c.313]
К другой группе — сферопротеинам (они называются также глобулярными белками) — относятся белки, третичная структура которых напоминает сферические объекты. Они встречаются во всех видах тканей и имеют самое разное назначение. Так, многие из них являются ферментами, другие — антителами. В крови (а также в мышцах, молоке и яйцах) присутствуют альбумины и глобулины. В ядрах клеток содержатся гисто-ны. Тромбин участвует в превращении растворенного в крови [c.194]
В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов. Высокая химическая специфичность ферментов связана отчасти с уникальной макроструктурой этих полимеров. Сложность общей структуры белков можно оценить на примере фермента рибоиуклеазы (рис. 25-12). В то время как вторичная структура белков определяется только водородными связями, многочисленные изгибы полипептидной цепи, придающие глобулярным белкам третичную структуру, зависят не только от пептидных связей и водородных связей между амидными группами, но и от других типов связей, а именно а) дисульфидных связей в цистине б) ионных связей, в которых участвуют дополнительные аминогруппы или карбоксильные группы в) водородных связей и г) гидрофобных взаимодействий (рис. 25-13). [c.410]
Глобулярные белки растворимы в воде и разбавленных солевых растворах и обладают шарообразной формой молекулы (эллипсоид вращения). Компактная структура возникает прн определенном сворачивании полипептидной цепи в основе такой структуры, по существу, лежит гидрофобное взаимодействие неполярных боковых цепей аминокислот. Помимо этого во взаимодействии отдельных участков цепн играют роль водородные связи и в некоторой степени ионные связи. Хорошая растворимость глобулярных белков объясняется локализацией иа поверхностн глобулы заряженных аминокислотных остатков, которые, окружая себя гидратной оболочкой, обеспечивают хороший контакт с растворителем. К глобулярным белкам относятся все ферменты и, за исключением структурных, большинство других биологически активных белков. [c.344]
Фактором, благоприятствующим гидрофобным взаимодействиям, является изменение энтропии, точнее говоря, ее прирост. В случае глобулярных белков полярные и прежде всего почти все ионные группы находятся на поверхности, чем облегчается гидратащ1я молекулы белка, имеющая большое значение для стабилизации пространственной структуры. У некоторых белков удаление воды неизбежно связано с их денатурацией. Большая часть неполярных остатков, напротив, находится внутри молекулы белка. Они укладываются плотно один к другому и практически выдавливают воду из первоначально еще непрочной клубковой структуры полипептидной цепи, что приводит к компактности и стабильности гидрофобного ядра. Само собой разумеется, что часть функциональных (ионных) групп боковых цепей находится внутри молекулы белка. Группы, оказавшиеся замаскированными, не подвергаются внешним воздействиям (изменение pH, реакции модификации и др.). Более того, измененная реакционноспособность таких функциональных групп, имеющая значение для каталического действия ферментов, определяется гидрофобным окружением и взаимодействием с [c.382]
Ангиотензин II - октапептидный тканевый гормон, входит в качестве центрального действующего элемента в ферментную ренин-ангиотензино-вую систему, в которой осуществляется его биогенез и распад. Ангиотензин II - самый мощный из известных прессорных агентов в системе крово-Ьбращения. Он стимулирует сужение периферических артериол по всему организму и тем самым повышение артериального давления. Помимо этого ангиотензин II активизирует секрецию ряда гормонов (главным образом альдостерона), влияет на работу сердца, печени, центрального и периферического отделов нервной системы, а также вызывает ряд других откликов в организме млекопитающих. Его биохимический предшественник - ангиотензин I, образуется, согласно приведенной ниже схеме, из глобулярного белка крови ангиотензиногена при действии протеолитиче-ского фермента ренина. [c.269]
Например, в кристаллах миоглобина и гемоглобина их от 5 до ю лизоцима - всего 5. Дж. Рапли, детально изучивший этот вопрос, в своем обзоре пишет "...кристалл глобулярного белка можно рассматривать как упорядоченный и открытый ансамбль компактных молекул, имеющих почти что минимальный контакт с областью, не занятой твердым веществом. Эта область составляет около половины объема кристалла-она непрерывна, заполнена растворителем, аналогичным основной массе жидкости, и состоит из каналов, способных вместить молекулы соединений с молекулярной массой более 4000 [354. С. 257]. Полностью исключить возможность отклонения структуры белка в кристалле от структуры в растворе тем не менее нельзя. Но несомненно и то, что в большинстве случаев изменения могут коснуться только положений некоторых боковых цепей в областях контактов на периферии глобулы. Вероятность, что конформационные нарушения произойдут, и произойдут именно в активном центре, невелика, конечно, в том случае, когда кристаллизация осуществляется в условиях, близких к тем, при которых фермент или другой белок проявляет активность. При идентичности структур фермента в кристалле и растворе различия в эффективности катализа могут быть обусловлены лишь разными условиями диффузии субстрата и продуктов реакции и стерическими затруднениями для конформационных перестроек активного центра. Дж. Рапли по этому поводу замечает "...кристаллический белок обладает ферментативной активностью, и, хотя его свойства несколько отличаются от свойств растворенного белка, сам факт каталитического действия кристаллического фермента служит достаточно убедительным аргументом против предположения о большом изменении конформации в процессе кристаллизации [354. С, 271]. Таким образом, можно заключить, что рентгеноструктурные данные почти всегда правильно отражают укладку основной цепи белка и, как правило, буквально воспроизводят биологически активную конформацию. Поэтому все, что говорится Меклером и Идлис о "жидком" и "твердом белке, по моему мнению, представляется глубоко ошибочным и выглядит не более, чем попыткой спасти идею стереохимического кода. Неудачно также отождествление жидкого" белка с "расплавленной глобулой". Трудно предположить, что короткоживущее промежуточное состояние, которое возникает на последней стадии свертывания полипептидной цепи и о котором пока имеется лишь туманное предствление, является активной формой белка, способной функционировать длительное время. [c.538]
Обычно активные центры ферментов включают части всех структурных доменов глобулярного белка. Активные центры всех известных мультидоменных белков (табл. 5.2) расположены между доменами (рис. 4.1). Эти домены определяются не только как глобулярные области, разделенные полостью активного центра, но имеют и другое характерное для доменов свойство — они связаны между собой только одной пептидной цепью (табл. 5.2). Субстраты и кофакторы обычно присоединяются к разным доменам. В случае NAD связывающий кофактор домен всегда имеет ту же самую с довольно развитой открытой поверхностью топологию н NAD присоединяется в эквивалентных положениях (рис. 5.17, б), что является результатом эволюции [254, 255]. Кроме того, этот домен обнаружен на N-конце трех дегидрогеназ и одной киназы [230— 233, 235], а также на С-концевой половине четвертой дегидрогеназы [234] и в средней части фосфорилазы [236], что указывает на возможность дупликации соответствующего гена и его переноса в другое место генома. Все эти факты, включение в активный центр частей различных доменов, наличие кофакторепецифичных доменов и возможность переноса домена дают основание предположить, что ферменты конструируются с использованием модульной системы кофактор и субстратспецифичные домены, необходимые для обеспечения заданной функции, отбираются и объединяются в одной цепи глобулярного белка [124, 256]. [c.117]
Форма выделяемых частиц не всегда сферическая, и тогда в используемые методы вносят необходимые поправки, или выбирают какие-либо другие способы изоляции и расчета Ферменты — глобулярные белки, поэтому при их разделении играют роль, в основном, молекулярные массы (ММ) молекул, а не число субъединиц (С) в них В качестве примера можно назвать химотрипсин (ММ = 24500 Да, С = 3), щелочную фосфатазу (ММ = 80000 Да, С = 2), лактатдегидрогеназу (ММ = 140000 Да, С = 4), триптофаназу (ММ = 220000 Да,С = 8), и др Более того, известны ферменты, катализирующие одну и ту же реакцию в организме одного вида, но представляющие собой различные молекулярные формы Их называют изоферментами, выделение которых по высказанным причинам заметно осложняется [c.49]
Заканчивая этот раздел, необходимо подчеркнуть, что в создании третичной структуры белков, вероятно, участвует много других факторов Например, папаин не имеет дисульфидных связей, а энолаза не содержит остатков ни цистеина, ни цистина однако оба эти фермента сохраняют глобулярную форму. Чибнелл полагал, что в белках имеются тиоловые эфиры, а недавно было высказано предположение о существовании связей этого типа в активном центре папаина. [c.38]
Белки могут быть разбиты на два больших класса в соответствии с формой их молекул и некоторыми физическими свойствами глобулярные и фибриллярные белки (рис. 6-1). В глобулярных белках одна или большее число полипептидных цепей свернуты в плотную компактную структуру сферической, или глобулярной, формы. Обьлно глобулярные белки растворимы в водных системах и легко диффундируют одни из.этих белков выполняют функции, обусловленные их подвижностью, а другие функционируют как динамические системы. К глобулярным белкам относятся почти все ферменты, равно как и транспортные белки крови, антитела и пищевые белки. Фибриллярные белки представляют собой нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых не имеют глобулярной формы, а вытянуты вдоль одной оси. Большинство фибриллярных белков выполняет структурные или защитные функции. Типичными фибриллярными белками являются а-кератин волос и шерсти, фиброин шелка и коллаген сухожилий. [c.140]
Белки пищи расщепляются ферментами в желудочно-кишечном тракте до составляющих их аминокислот. Белки, поступающие в желудок, стимулируют выделение гормона гастрина, который в свою очередь вызывает секрецию соляной кислоты обклаЭочньши клетками желез слизистой желудка (рис. 24-3), а также пепсиногена главными клетками. Желудочный сок имеет pH от 1,5 до 2,5. Благодаря такой кислотности он действует как антисептик, убивая большинство бактерий и других клеток. Кроме того, в условиях низкого pH желудочного сока глобулярные белки подвергаются денатурации, их молекулы разворачиваются и вследствие этого внутренние пептидные связи полипептидных цепей становятся более доступными для ферментативного гидролиза. Пепсиноген (мол. масса 40000), являющийся неактивным предшественником фермента, или зимогеном, превращается в желудоч- [c.747]
Две цепи ДНК, по Уотсону и Крику, образуют совместную спираль (рис. 95), в которой основания расположены внутри спирали, а остатки фосфорной кислоты — снаружи. Расположение обеих цепей в спирали взаимно строго обусловлено условиями упаковки и образования водородных связей между аденином и тиминоми между гуанином и цитозином,— они всегда располагаются друг против друга, но внутри каждой цепи чередование нуклеотидов своеобразной специфично у каждого вида организмов. Интересно, что шаг спирали на одно нуклеотидное звено (3,4 А) практически совпадает с периодом повторяемости на один аминокислотный остаток в вытянутой полипептидной цепи. Взаимоотношение между спиралями ДНК и глобулярных белков (ферментов) представляет исключительный биологический интерес и в настоящее время подробно исследуется. [c.214]
Конформация полипептида в растворе частично определяется прямым взаимодействием пептидных групп друг с другом. То обстоятельство, что синтетические по-липептидй имеют высокорегулярную, кристаллическую структуру, тогда как многие другие- полимеры аморфны, т. е. обладают структурой беспорядочного клубка, в принципе свидетельствует о наличии некой естественной конформации для полипептидов. Результаты тщательной оценки длины связей и валентных углов, основанной на размерах, установленных для планарных пептидных связей в кристаллах небольших пептидов, существенно ограничили число возможных моделей конформации полипептидов. Дальнейшие ограничения в выборе возможной конформации были связаны с тем, что, согласно исходным предположениям, каждая карбонильная и каждая амидная группа пептида участвует в образовании водородной связи и что конформация полипептида должна соответствовать минимальной энергии вращения вокруг одинарной связи. Этим требованиям для пептидов, в которых имеются внутримолекулярные связи, отвечала правая спираль, содержащая 3,6 аминокислотных остатка на один виток (так называемая а-спираль) [1].. Существование спиральных структур предсказанных размеров в синтетических полипептидах было подтверждено с помощью самых различных физических методов, в том числе и методом рентгеноструктурного анализа. Такая а-спираль, в которой каждая пептидная группа соединена водородной связью с третьей от нее пептидной группой, считается наиболее вероятной моделью отдельных участков остова молекулы глобулярных белков, к которым относятся и ферменты. Нужно подчеркнуть, однако, что конформация глобулярного белка в целом отличается от простой регулярной а-спиральной структуры из-за наличия, в белке дисульфидных связей и остатков пролина, которые нарушают спиральное строение и изменяют ориентацию цепи, а также из-за взаимодействия боковых цепей, ответственного за третичную структуру. Действительно, рентгеноструктурный анализ с высоким разре- [c.25]
Затруднение первого типа связано с тем, что реакционноспособность группировки в глобулярном белке зависит от ее химического окружения, так что она может быть замаскирована в отношении потенциального инактивирующего реагента, хотя и доступна действию с5уб-страта или какого-либо другого реагента. Таким образом, неспособность реагента инактивировать фермент может служить основанием для тех или иных выводов лишь в том случае, если показано, что сама реакция с ферментом произошла. Трудности второго типа возникают вследствие повышения реакционноспособности некоторых группировок, которые в результате начинают взаимодействовать с данным реагентом, хотя в нормальном случае они с ним не взаимодействуют. В качестве примера можно привести недавнюю работу Такахаси и др. [9], показавшую, что карбоксильная группа рибонуклеазы Т] реагирует с иодацетатом, который известен как реагент на более сильные нуклеофильные группы типа сульфгидрильной или имидазольной. Можно сослаться также на другую работу [10], в которой показано, что Ы-этилмалеимид может реагировать с е-аминогруп-пой лизина, а не с сульфгидрильной группой, в отношении которой он, как принято считать, специфичен. [c.220]
Первым глобулярным белком, для которого была определена пространственная структура, был миоглобин кашалота, исследованный Дж. Кэндрью и сотр. Опубликован прекрасный обзор этих работ [5]. Кроме того, можно рекомендовать четыре более поздние публикации, описывающие структуры белков из других источников. Структуры миоглобина, гемоглобина, лизоцима, рибонуклеазы, химотринсина, папаина и карбоксипептидазы А обсуждаются в иллюстрированной книге Дикерсона и Рейса [6]. Исследование карбоксипептидазы А, химотрипсиногена, химо-трипсина, эластазы, папаина и субтилнзина обсуждается в одном из томов Ферментов [7]. Структуры гемоглобина и миоглобина, а также различные свойства этих белков послужили темой еще одной книги [8]. Наконец, не так давно была описана структура цитохрома с [9]. Многие из этих статей иллюстрированы рисунками-стереопарами, дающими объемное изображение молекул при рассматривании их через специальные очки. [c.491]
Реплики поперечного среза мембран имели типичное трехслойно строение, причем на поверхности мембран были обнаружены сферические частицы (размер 6,0—25,0 нм). Предполагают, что частицы представляют собой липопротеидные субъединицы и располагаются внутри мембраны. Однако это маловероятно, поскольку частицы не выявляются на поперечных срезах мембран, где отчетливо просматривается трехслойная структура с гомогенным средним слоем. По мнению других исследователей, частицы представляют собой наружный белковый компонент мембраны, однако неясно, почему они не выявляются в некоторых мембранах. Возможно, частицы следует рассматривать как комплексы глобулярных белков-ферментов, адсорбированные мембраной или частично пронизывающие ее. [c.378]
В молекулах белков (альбумины,, глобулины, ферменты и др.) и полипептидов цепи построены из большого количества разнообразных остатков -аминокислот. Помимо последовательно соединяющих их плоскорасположенных пептидных связей —СО—N11 —, аминокислотные остатки связаны большим количеством водородных связей с удаленными остатками. Условия максимального насыщения внутримолекулярных водородных связей и максимальной плотности упаковки аминокислотных остатков в цени нри соблюдении обычных валентных углов и расстояний приводят к характерному свертыванию цепи в спирали. По теории Паулинга и Корея, в глобулярных белках, а-кератине и некоторых полипептидах свертывание происходит по типу а-спирали (рис. 120), где на 3 витка спирали приходится по 11 остатков и через каждый третий аминокислотный остаток между] пептидными группами образуется водородная связь (отмечена пунктиром), параллельная оси спирали. Последовательность аминокислотных остатков различна для каждого белка, что создает на поверхности спирали из боковых цепей аминокислот специфичный рельеф, определяющий структуру центров ферментативной, антигенной,, гормональной и других активностей белка. Взаимодействие боковых цепей вызывает также специфические для каждого белка отклонения основного хода спирали. В фибриллярных белках (фиброин шелка, В-кератин, миозин и др.) спирали вытянуты и водородные связи соединяют соседние цепи по перпендикулярным к их осям направлениям. [c.274]
Расположение обеих цепей в спирали взаимно строго обусловлено условиями упаковки и образования водродных связей между аденином и тимипом и между гуанином и цитозином, которые всегда должны располагаться друг против друга, но внутри каждой цепи чередование нуклеотидов является своеобразным и специфичным у каждого вида организмов. Интересно, что шаг спирали на одно нуклеотидное звено (3,4 А) практически совпадает с периодом вытянутой полипептид-ной цепи на один аминокислотный остаток. Взаимоотношение между спиралями ДНК и глобулярных белков (ферментов) представляет исключительный биологический интерес и подробно исследуется. [c.275]
Однако имеются многочисленные случаи связывания ионов с глобулярными белками, которые не поддаются такому простому объяснению. Обнаружено, например, что некоторые ферменты, для каталитической активности которых необходимы специфические ионы, связывают эт1г ионы значительно прочнее, чем этого можно было ожидать из известного поведения лигандов, принадлежащих ферменту. Специфичность связывания ионов часто таки е совершенно отлична от поведения низкомолекулярных комплексообразователей. Например,ферментенолаза активируется ионом 7п +, который, как известно, образует очень устойчивые комплексы, а также ионами Mg + и Мп +, являющимися плохими комилексообра-зователями. Никакими другими ионами этот фермент ие активируется [928]. Константа ассоциации енолазы с при pH 7,2 составляет 3300 [9281, а константа ассоциации карбоангидразы с активирующим 7п + при pH 7,5 равна 10 [929]. Эти высокие значения, несомненно, указывают на кооперативный эффект нескольких лигандов, располагающихся [c.323]
Другое подобное полимеризационное явление наблюдается для фибриногена — глобулярного белка, ответственного за свертывание крови. Обзор литературы по этому вопросу был сделан Шерагой и Ласковским [999]. Нативный фибриноген наблюдается в электронном микроскопе в виде линейной структуры, состоящей из трех узелков, связанных сравнительно тонкой нитью [1000]. В этой форме белок не обладает способностью к образованию агрегатов. Однако под действием протеолитическо-го фермента тромбина от фибриногена отщепляется небольшая пептидная молекула, и оставшийся белок ( фибриновый мономер ) проявляет высокую тенденцию к ассоциации с образованием больших структур и в конечном счете сшитого геля. Процесс поперечного сшивания может быть ингибирован различными реагентами в этих условиях можно изучать ассоциацию фибринового мономера до стержневидных полимеров. Исследование методом светорассеяния позволяет предположить, что поперечное сечение этих стержней в два раза больше поперечного сечения фибринового мономера, на основании чего было предположено [1001,1002], что линейный полимер фибрина растет в результате ступенчатого перекрытия удлиненных мономерных звеньев, как это схематически изображено на рис. 130, б. Однако размеры стержневидного фибринового полимера, наблюдаемые в электронном микроскопе, по-видимому, исключают ассоциацию путем параллельного расположения [1000], и причина этого расхождения еще не выяснена. [c.339]
Белки (или протеины) представляют собой один из самых значительных и наиболее разнообразных классов природных макромолекулярных соединений. Эти полимеры являются продуктами жизнедеятельности всех видов животных и растительных организмов и имеют первостепенное значение для жизненных процессов и питания. Все белки делятся на два обширных класса—фибриллярные и глобулярные. Глобулярные белки растворимы в воде и легко поддаются химическим превращениям в живых организмах они находятся в виде сфероидальных частиц, что и послужило основанием для названия этого класса веществ. Эта группа белков выпол-йяет разнообразнейшие биологические функции и непосредственно связана с основными процессами жизнедеятельности. Так, например, они выступают в роли ферментов, гормонов, антител, токсинов и других важнейших составных частей растущих и размножающихся клеток. [c.326]
Рассмотренный пример не является исключением. Так, С-концевой полипептид папаина из ПО остатков, представляющий собой достаточно автономную область трехмерной структуры, был отнесен, как и а-химотрипсин, к -структурным белкам [157]. Следовательно, формирование его конформации должно проходить в принципе так же, как у рассмотренного фермента. Но С-концевой домен папаина содержит лишь восемь -структурных остатков и приходится описывать весь процесс укладки, не воспользовавшись другими 102 остатками, в том числе 11 а-спиральными. Еще один пример. Инсулин причислен к а-структурной группе [157]. Поэтому при сборке его структуры не замечается уже -структурный участок. Принципиальный недостаток схемы уровней структурной организации глобулярных белков Шульца и Ширмера заключается в том, что в ней не учитывается существование нерегулярных участков полипептидной цепи, иными словами, сборка третичной структуры представляется только путем ассоциации вторичных и супервторичных структур и состоящих из них доменов. И такое представление не претерпело каких-либо изменений и остается общепринятым и сегодня. В 1989 г., т.е. спустя десять лет после выхода в свет монографии Г. Шульца и Р. Ширмера, Г. Фасман писал ...стало очевидно, что третичное свертывание определяется главным образом упаковкой а-спиралей и/или -структур... Супервторичные структуры являются главными компонентами доменов, которые, будучи собранными, составляют трехмерные конформации белков [238. С. 236]. [c.313]
chem21.info
4. Классификация белков
Часть белков включает только аминокислоты, но обычно из-за их лигандности в организме формируются более сложные структуры. Поэтому их и классифицируют следующим образом (рис. 9):
4.1. Простые белки
Простые белки – это биополимеры, состоящие только из аминокислот.
По форме они подразделяются на глобулярные и фибриллярные.
4.1.1. Глобулярные белки
Они довольно сложно организованы, имеют третичную структуру, поэтому растворимы в воде. Из-за направленности заряда их делят на:
Основные. В этих белках содержится много основных аминокислот (аргинина и лизина), что позволяет им приобретать положительный заряд, облегчая растворимость.
Наиболее яркие представители:
Протамины - самые маленькие низкомолекулярные белки (Мr 5000 Д), впервые выявлены в зрелой сперме некоторых рыб. Включают до 85% аргинина. Являются основными компонентами нуклеопротеидов хроматина ядра спермиев, а также полирибосом, что сохраняет и регулирует передачу генетической информации при делении клеток и между особями.
Гистоны –белки с большей, чем у протаминов, молекулярной массой от 11 до 21 тыс. Д. Вклад основных аминокислот лизина и аргинина меньше и составляет от 20 до 30%. Это гетерогенная фракция. Различают 5 классов гистонов: Н1, Н2а, Н2b,Н3, Н4. Их молекулы (кроме Н1) легко взаимодействуют друг с другом, образуя мультимеры – октамеры. В свободном виде они не встречаются, а входят в состав сложных белков – нуклеопротеидов (рис. 10), выполняя следующие функции: структурную и регуляторную. Первая заключается в формировании и стабилизации пространственной компановки молекулы ДНК. Вторая обусловлена тем, что – находясь в связи с этим хранителем информации, они блокируют её передачу на РНК.
Кислые. Это широко распространённые белки в основном, внеклеточных жидкостей. Наиболее богаты ими плазма крови, лимфа, ликвор, молоко и т.д. Из-за преобладания в них кислых аминокислот (глутамата и аспартата) растворы имеют кислый характер.
К ним относят:
Альбумины. Их Мr = 40-70 тыс.Д. Молекулы представляют одну полипептидную цепь небольших размеров. Из-за высокого содержания глутаминовой кислоты имеют солидный отрицательный заряд. Это сильно гидратированные белки (с огромной гидратной оболочкой), поэтому осаждаются только при большой концентрации водоотнимающих средств, а также устойчивы к нагреванию.
Характерным свойством альбуминов является их способность связывать лиганды и адсорбировать на своей поверхности вещества, перенося их с током биологической жидкости. Таким способом в комплексе с ними плазмой крови доставляются к клеткам гормоны, липиды, витамины, лекарства, яды, катионы металлов и т.д.; кроме того эти протеины обеспечивают онкотическое давление плазмы крови и являются её составляющей буферной системы.
Глобулины – это белки с большой молекулярной массой свыше 150 тыс. Д. По сравнению с альбуминами в их составе меньше кислых аминокислот. В отличие от них это слабо гидратированные мицеллы, поэтому легко высаливаются. Кроме того они гетерогенны, что подтверждается при электрофорезе на бумаге, после разгонки регистрируют пять фракций: 1, 2, β1, β2,. Последняя (нейтральные глобулины) является самой крупной и наиболее разнообразной. В ней сосредоточены некоторые факторы свёртывания крови и различные антитела (иммуноглобулины). Отсюда следует, что глобулины выполняют не только функции, подобные альбуминам, но и предохраняют организм от неадекватных кровопотерь и участвуют в его иммунной защите. Они являются составляющей сложных белков – гликопротеинов и липопротеинов.
Соотношение величин альбуминов и глобулинов в плазме крови называется белковым коэффициентом ().
В норме он сохраняется на постоянном уровне и составляет 1,5 – 2,3. Данный параметр изучают с целью диагностики различных патологических состояний. Например: при инфекционных заболеваниях после разделения белков плазмы крови оценивают соотношение величин альбуминов и глобулинов и находят белковый коэффициент (). Если организм борется с инфекцией, то закономерно повышается уровень иммунных защитников -глобулинов в крови, что снижает значения дроби: белковый коэффициент 1,5. Если не борется (что плохо), то величины остаются в пределах нормы, следовательно, врачебная тактика должна быть более активной: требуется дополнительное введение иммуностимуляторов (веществ, усиливающих образование антител) или готовых -глобулинов.
studfiles.net












