Стандарты и нормы pH для питьевой воды. Аш пэ
Кислотно-щелочное равновесие. Здоровый показатель pH
Кислотно-щелочное равновесие.
Показатель pH и его влияние на качество питьевой воды.
Что такое pH?
pH («potentia hydrogeni» — сила водорода, или «pondus hydrogenii» — вес водорода) — это единица измерения активности ионов водорода в любом веществе, количественно выражающая его кислотность.
Данный термин появился в начале ХХ века в Дании. Показатель pH ввел датский химик Сорен Петр Лауриц Соренсен (1868-1939), хотя утверждения о некой «силе воды» встречаются и у его предшественников.
Активность водорода определяется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+]
Для простоты и удобства при вычислениях был введен показатель pH. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Принято измерять уровень pH по 14-цифровой шкале.

Если в воде пониженное содержание свободных ионов водорода [H+] (рН больше 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН меньше 7) — кислую реакцию. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга.
кислая среда: [H+] > [OH-]нейтральная среда: [H+] = [OH-]щелочная среда: [OH-] > [H+]
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. В нейтральной воде показатель рН равен 7.
При растворении в воде различных химических веществ этот баланс изменяется, что приводит к изменению значения рН. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении щелочи — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает.
рН показатель отражает степень кислотности или щелочности среды, в то время как «кислотность» и «щелочность» характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Опустив руку в воду, мы можем сказать какая вода — прохладная или теплая, но при этом не сможем определить сколько в ней тепла (т.е. условно говоря, как долго эта вода будет остывать).
pH считается одним из важнейших показателей качества питьевой воды. Он показывает кислотно-щелочное равновесие и влияет на то, как будут протекать химические и биологические процессы. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. От кислотно-щелочного равновесия среды нашего организма напрямую зависит наше самочувствие, настроение и здоровье.
Современный человек живет в загрязненной окружающей среде. Многие приобретают и употребляют пищу, изготовленную из полуфабрикатов. Кроме этого практически каждый человек ежедневно подвергается стрессовому воздействию. Все это оказывает влияние на кислотно-щелочное равновесие среды организма, смещая его в сторону кислот. Чай, кофе, пиво, газированные напитки снижают показатель pH в организме.
Считается, что кислая среда является одной из основных причин разрушения клеток и повреждения тканей, развития заболеваний и процессов старения, росту болезнетворных организмов. В кислой среде до клеток не доходит строительный материал, разрушается мембрана.
Кислая среда провоцирует множество заболеваний, среди которых сердечно-сосудистые заболевания, артрит, остеопороз, онкологические заболевания и др, а так же способствует развитию бактерий, вирусов, грибков, гельминтов и прочих паразитов. Паразиты предпочитают кислую среду обитания, и именно в кислотной среде они проявляют себя наиболее патогенно. Кислую среду в организме создают психические и физические перегрузки, мясо, пища, прошедшая глубокую термическую и иную технологическую обработку, снижающую содержание в ней полезных веществ. Эти же источники закисления наполняют организм свободными радикалами, которые перегружают иммунную систему. Один из признаков закисления организма — некомфортная сухость во рту.
Внешне о состоянии кислотно-щелочного равновесия крови человека можно судить по цвету его конъюнктивы в уголках глаз. При оптимальном кислотно-щелочном балансе цвет конъюнктивы ярко-розовый, если же у человека повышается щелочность крови, конъюнктива приобретает темно-розовый окрас, а при повышении кислотности окрас конъюнктивы становится бледно-розовым. При чем цвет конъюнктивы изменяется уже через 80 секунд после употребления веществ, влияющих на кислотно-щелочное равновесие.
Организм регулирует рН внутренних жидкостей, поддерживая значения на определенном уровне. Кислотно-щелочной баланс организма — это определенное соотношение кислот и щелочей, способствующее его нормальному функционированию. Кислотно-щелочной баланс зависит от сохранения относительно постоянных пропорций между межклеточными и внутриклеточными водами в тканях организма. Если кислотно-щелочное равновесие жидкостей в организме не будет поддерживаться постоянно, нормальное функционирование и сохранение жизни окажутся невозможными. Поэтому важно контролировать то, что вы потребляете.

Кислотно-щелочной баланс – это наш индикатор здоровья. Чем мы «кислее», тем скорее стареем и больше болеем. Для нормальной работы всех внутренних органов уровень рН в организме должен быть щелочным, в интервале от 7 до 9.
pH внутри нашего тела не всегда одинаков — некоторые его части более щелочные, а некоторые кислотные. Организм регулирует и поддерживает гомеостаз уровня pH лишь в отдельных случаях, например pH крови. На уровень pH почек и других органов, кислотно-щелочное равновесие которых не регулируются организмом, влияют пища и напитки, которые мы употребляем.
pH крови
Уровень pH крови поддерживается организмом в диапазоне 7.35-7.45. Нормальным показателем pH крови человека считается 7,4-7,45. Даже незначительное отклонение этого показателя влияет на способность крови переносить кислород. Если pH крови повышается до 7,5, она переносит на 75% кислорода больше. При снижении показателя pH крови до 7,3 человеку уже сложно подняться с постели. При 7,29 он может впасть в кому, если показатель pH крови снизится ниже 7,1 — человек умирает.
Уровень pH крови должен поддерживаться в здоровом диапазоне, поэтому организм использует органы и ткани для поддержания его постоянства. Вследствие этого, уровень pH крови не меняется из-за употребления щелочной или кислотной воды, но ткани и органы тела, используемые для регулировки pH крови, меняют свой pH.
pH почек
На параметр pH почек оказывает влияние вода, пища, метаболические процессы в организме. Кислотная еда (например мясные продукты, молочные продукты и др.) и напитки (сладкие газированные напитки, алкогольные напитки, кофе и пр.) приводят к низкому уровню pH в почках, потому что организм выводит излишнюю кислотность через мочу. Чем ниже уровень pH мочи, тем тяжелее приходится работать почкам. Поэтому кислотная нагрузка, приходящаяся от такой еды и напитков на почки, называется потенциальной кислотно-почечной нагрузкой.
Употребление щелочной воды приносит почкам пользу — происходит повышение уровня pH мочи, снижается кислотная нагрузка на организм. Увеличение pH мочи повышает pH организма в целом и избавляет почки от кислотных токсинов.
pH желудка
В пустом желудке содержится не больше чайной ложки желудочной кислоты, выработанной в последний прием пищи. Желудок производит кислоту по мере необходимости при употреблении пищи. Желудок не выделяет кислоту, когда человек пьет воду.
Очень полезно — пить воду на пустой желудок. Показатель pH увеличивается при этом до уровня 5-6. Увеличенный pH будет иметь мягкий антацидный эффект и приведет к увеличению количества полезных пробиотиков (благотворных бактерий). Увеличение pH желудка повышает pH организма, что ведет к здоровому пищеварению и освобождает от симптомов расстройства желудка.
pH подкожного жира
Жировые ткани организма имеют кислотный pH, поскольку в них откладываются излишние кислоты. Организму приходится хранить кислоту в жировых тканях, когда она не может быть выведена или нейтрализована иными способами. Поэтому смещение pH организма в кислую сторону — это один из факторов лишнего веса.
Позитивное влияние щелочной воды на массу тела состоит в том, что щелочная вода помогает выводить из тканей излишнюю кислоту, поскольку помогает почкам работать более рационально. Это помогает контролировать вес, поскольку многократно снижается количество кислоты, которое тело должно «хранить». Щелочная вода также улучшает результаты здоровой диеты и упражнений, помогая организму справиться с излишней кислотностью, выделяемой жировыми тканями в процессе потери веса.
Кости
У костей щелочной pH, так как они в основном состоят из кальция. Их pH постоянен, но если кровь нуждается в регулировке pH, кальций забирается из костей.
Польза, приносимая щелочной водой костям, состоит в их защите, путем снижения количества кислоты, с которым организму приходится бороться. Исследования показали, что употребление щелочной воды снижает рассасывание костей — остеопороз.
pH печени
У печени слабощелочной pH, на уровень которого влияет и пища, и напитки. Сахар и алкоголь должны быть расщеплены в печени, а это приводит к излишкам кислоты.
Польза, приносимая щелочной водой печени, состоит в наличии в такой воде антиоксидантов; установлено, что щелочная вода усиливает работу двух антиоксидантов, находящихся в печени, способствующих более эффективному очищению крови.
pH организма и щелочная вода
Щелочная вода позволяет частям тела, сохраняющим pH крови, работать с большей производительностью. Повышение уровня pH в частях тела, отвечающих за поддержание pH крови, поможет этим органам оставаться здоровыми и работать оперативно.
Между приемами пищи Вы можете помочь Вашему организму нормализовать показатель pH, употребляя щелочную воду. Даже небольшое увеличение pH может оказать огромное влияние на состояние здоровья.
По данным исследований японских ученых, показатель pH питьевой воды, находящийся в диапазоне 7-8, повышает продолжительность жизни населения на 20-30%.
В зависимости от уровня рН воды можно условно разделить на несколько групп:
• сильнокислые воды < 3• кислые воды 3 — 5• слабокислые воды 5 — 6.5• нейтральные воды 6.5 — 7.5• слабощелочные воды 7.5 — 8.5• щелочные воды 8.5 — 9.5• сильнощелочные воды > 9.5
Обычно уровень рН питьевой водопроводной воды находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. В речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3.
ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
| |||||||||||||||||||||||||||||||||||||||||||||||




Интересно знать: Немецкий биохимик ОТТО ВАРБУРГ, удостоенный в 1931 Нобелевской премии по физиологии и медицине доказал, что недостаток кислорода (кислая среда pH<7.0) в тканях приводит к изменению нормальных клеток в злокачественные.
Ученый обнаружил, что раковые клетки теряют способность к развитию в среде, насыщенной свободным кислородом с показателем pH=7,5 и выше! Это означает, что когда жидкости в организме становятся кислыми, стимулируется развитие рака.
Его последователи в 60-х годах прошлого столетия доказали, что любая патогенная флора теряет способность размножаться при pH=7,5 и выше, и наша иммунная система легко справляется с любыми агрессорами!
Для сохранения и поддержания здоровья нам необходима правильная щелочная вода (рН=7.5 и выше). Это позволит лучше сохранять кислотно-щелочное равновесие жидкостей организма, так как основные жизненные среды имеют слабощелочную реакцию.
Уже при нейтральной биологической среде организм может обладать удивительной способностью к самоисцелению.

Не знаете где можно взять правильную воду? Я подскажу!

Обратите внимание:
Нажатие на кнопку «Узнать» не ведет к каким-либо финансовым тратам и обязательствам.
Вы лишь получите информацию о доступности правильной воды в Вашем регионе,
а так же получите уникальную возможность бесплатно стать членом клуба здоровых людей
и получить скидку 20% на все предложения + накопительный бонус.

Вступи в международный клуб здоровья Coral Club, получи БЕСПЛАТНО дисконтную карту, возможность участия в акциях, накопительный бонус и другие привилегии!

lifezone.su
1.7. Водородный показатель среды растворов – pH.
Водородный показатель – рН – это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
pН = – lg[H+]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni – сила водорода, или pondus hydrogenii – вес водорода.
Несколько меньшее распространение получила обратная pH величина – показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
рОН = – lg[OH–]
В чистой воде при 25°C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10-7моль/л, это напрямую следует из константы автопротолиза воды Кw, которую иначе называют ионным произведением воды:
Кw = [H+] · [OH–] =10–14 [моль2/л2] (при 25°C)
рН + рОН = 14
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания – наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH–] говорят, что раствор является кислым, а при [OH–] > [H+] – щелочным.
Определение рН
Для определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
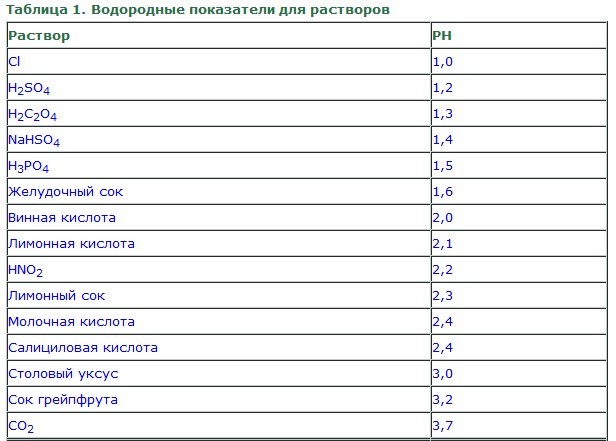
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы – органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах – либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы (см. Таблица 1, занятие 2).
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод – кислотно-основное титрование – также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титранта точно хватает, чтобы полностью завершить реакцию, – фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред (Табл. 2).
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем.
3) Использование специального прибора – pH-метра – позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов, отличается удобством и высокой точностью, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
С помощью рН-метра измеряют концентрацию ионов водорода (pH) в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных систем непрерывного контроля технологических процессов, в т. ч. в агрессивных средах.
рН-метр незаменим для аппаратного мониторинга pH растворов разделения урана и плутония, когда требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.
Прибор может использоваться в лабораториях стационарных и передвижных, в том числе полевых, а также клинико-диагностических, судебно-медицинских, научно-исследовательских, производственных, в том числе мясо-молочной и хлебопекарной промышленности.
Последнее время pH-метры также широко используются в аквариумных хозяйствах, контроля качества воды в бытовых условиях, земледелия (особенно в гидропонике), а также – для контроля диагностики состояния здоровья.
Таблица 2. Значения рН для некоторых биологических систем и других растворов
| Система (раствор) | рН |
| Двенадцатиперстная кишка | 7,0 – 7,8 |
| Желудочный сок | 1,6 – 1,8 |
| Кровь человека | 7,35 – 7,45 |
| Ликвор | 7,5 |
| Моча | 4,8 – 7,5 |
| Мышечная ткань | 6,7 – 6,8 |
| Панкреатический сок | 8,3 |
| Пот | 4,0 – 8,0 |
| Почки | 6,6 – 6,9 |
| Протоплазма клеток | 6,4 – 7,0 |
| Связки | 7,2 |
| Слёзы | 7,4 |
| Слюна | 6,35 – 6,85 |
| Тонкая кишка | 6,2 – 7,3 |
| Молоко | 6,6 – 6,9 |
| Морская вода | 8,0 |
| Белок куриного яйца | 8,0 |
| Апельсиновый сок | 2,6 – 4,4 |
| Томатный сок | 4,3 |
| Кофе | 5,0 |
| Чай | 5,5 |
studfiles.net
Норма pH для питьевой воды
Степень кислотно-щелочных показателей, определяющихся концентрацией водородных ионов, формирует параметры pH, которые в норме для питьевой воды, согласно правилам СанПинН, составляют 6-9 единиц. По этому показателю российские нормативы почти не отличаются от ЕС-директивы – 6,50-9,50 и от требований Агентства США по охране среды (USEPA) – 6,50-8,50.
Содержание статьи
При этом нормы рН воды, предназначенной для разных отраслевых нужд, отличаются от pH-нормы воды для питья. Например:
- в гидропонике используют растворы с уровнем 5,50-7,50 и разделением этого диапазона на более узкие сегменты в зависимости от конкретного вида растения,
- в общественных бассейнах этот норматив – 7,20-7,40; в частных шире – 7,20-7,60; по DIN 19643-1 – 6,50-7,60,
- при производстве пива используется водная основа с показателями 6,00-6,50,
- для безалкогольных напитков – 3,00-6,00,
- для экспортной водки показатель зависит от жёсткости технологической воды – и равен 7 при жёсткости от 0 до 0,60 мг-экв/л и 6,50 – при 0,61-1,2 мг-экв/л; в водках «внутреннего рынка» – pH <7,80,
- в химическо-волоконном производстве – 7,00-8,00,
- в красильно-отделочном – 6,50-8,50,
- в системах теплоснабжения параметр указывается при температуре +25ºС и находится в пределах 7,00-8,50 для открытых систем и в пределах 7,00-11,00 – для закрытых,
- в энерготехнических и паровых котлах – не меньше 8,50,
- в системах охлаждения: для оборотных и добавочных вод – 6,50-8,50, в циркуляционных холодного контура – 6,50-8,20, горячего контура – 6,80-8,00 и т. д.
Определение уровня и зависимостей pH
Шкала для определения характера кислотно-щелочной среды состоит из 14 единиц, где срединная величина pH=7 считается нейтральной. При смещении по этой шкале к началу (к нулю) растворы приобретают характер кислотных. При смещении к концу – характер щелочных. Чаще всего подобную зависимость отражают в таблицах с частой градацией:

Для сравнения – согласно ГОСТ 6709-96, дистиллят по рН может иметь значения в пределах 5,40-6,60.
Поскольку концентрация ионов водорода низкая (для нейтральной среды – это семь нулей после запятой), то показатель выражается в более привычном виде отрицательным десятичным логарифмом. В таблицах в качестве единиц измерения обычно записывают «pH, ед.» или мкг/л (микрограмм на литр).
Показатель рН отличается от показателя общей щелочности (water alkalinity), которая, выражаясь в мг-экв/л, определяется суммой гидроксильных ионов/ анионов слабых кислот в воде. Низкая щелочность провоцирует резкую смену рН под воздействием внешних факторов.
В природных водах pH, в большинстве случаев, находится в диапазоне 6,50-8,50,отражая зависимость от соотношений с одной стороны – свободного диоксида углерода, с другой – бикарбонат-иона. В болотных водах pH-значения ниже и смещаются в сторону кислотности. Часто именно этот параметр становится индикатором загрязнения на открытых водоемах, демонстрируя наличие стоков с повышенным содержанием кислоты или щёлочи.
При интенсивном фотосинтезе, который наблюдается летом, уровень показателя может повышаться до 8,50-9,00 ед. Также на значения параметра влияет концентрации карбонатов, подверженных гидролизу солей, гидроокисей, гуминовых веществ и др.
Значение уровня pH в повседневной жизни
Японские учёные провели сравнительные исследования потребителей в районах, где пользуются питьевой водой со значениями pH, смещёнными либо в сторону кислотности, либо в сторону щёлочности. Они пришли к выводу, что в районах, где этот показатель выше среднего, люди живут на 20-30% дольше по сравнению со средней продолжительностью жизни по стране. В качестве предположительной причины называется большая «комфортность» кислотных вод для развития патологический микрофлоры.
В связи с тем, что водопроводная вода действительно значительно влияет на состояние здоровья человека, некоторые технические аксессуары, которые контактируют с ней, начинают рекламироваться в качестве средств, способных изменить химические свойства воды. Например, экономители http://water-save.com/ описываются как устройства, которые «обогащают воду слабыми ионами, активизирующими обмен веществ». На самом деле достоверно подтверждается только экономический, но не «целебный» эффект установки экономителя.
Это, однако, не отрицает значения рН-параметра для организма. В каждой среде – в том числе, в различных средах человеческого организма – существуют свои «pH-ориентиры»:
- слюна – 6,8-7,4 (при высокой скорости слюноотделения – 7,8),
- слёзы – 7,3-7,5,
- кровь – 7,43,
- лимфа – 7,5,
- моча – 5,5 (диапазон 5,0-7,5) и т.д.
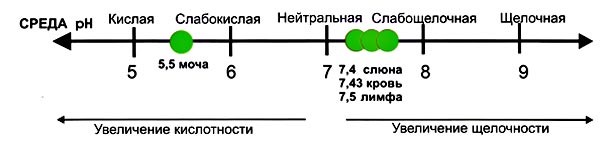
Для наглядной демонстрации кислотно-щелочного состояния различных сред существуют таблицы, в которых значения расположены в порядке возрастания:

Читайте далее
Оставьте комментарий и вступите в дискуссию
hitropop.com
Водородный показатель - это... Что такое Водородный показатель?
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН) — величина, характеризующая активность или концентрацию ионов водорода в растворах; численно равна отрицательному десятичному логарифму концентрации, выраженной в грамм-ионах на литр. рН = —1g(H+], где [Н+] — концентрация ионов водорода. Понятие рН введено для удобства расчетов, связанных с величиной [Н+]. В чистой воде [Н+] = [ОН-] = 10-7. Растворы, в которых при 25 °С рН > 7, являются щелочными, при рН около 7 — нейтральными, а при рН < 7 — кислыми. рН определяется электрометром (потенциометром) со стеклянным электродом. рН характеризует щелочнокислотное равновесие среды осадкообразования, так, напр., завышенные значения рН(> 7) способствуют осаждению кальцита, каков бы ни был механизм его образования — хемогенный или органогенный, а в среде с низкими величинами рН насыщения не достигается. рН суспензий м-лов также может служить дополнительным диагностическим признаком (рН каолинита 6,4—6,9, монтмориллонита 7,9—9,8, кальцита 9,4—9,5, доломита 9,6—10,1). рН морской воды обычно находится в пределах 7,5—8,5 (слабощелочная реакция). рН в осадках древних морей непосредственно определить нельзя, так как осадок с момента захоронения испытывает серию физико-хим. преобразований, изменивших первоначальный режим рН отложений. Косвенные указания могут дать парагенезы аутигенных диагенетических м-лов, но эти указания условны и ненадежны, ибо любой м-л (карбонаты, гидроокислы и др.) осаждается не при одной какой-либо величине рН, а в достаточно широких его интервалах согласно диаграмме равновесий соответствующих соединений.Геологический словарь: в 2-х томах. — М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978.
Водородный показательpH (a. pH-value; н. pH-Wert; ф. pH valeur; и. valor del pH), - характеризует концентрацию (точнее активность) ионов водорода в растворах; численно равен отрицат. десятичному логарифму концентрации ионов водорода (в грамм-ионах на 1 л): pH= lg(H+) г-ион/л, где (H+) - концентрация ионов водорода. Понятие pH введено в нач. 20 в. для удобства расчётов, связанных c концентрацией ионов водорода. pH водных растворов от 0 до 14. Pастворы, имеющие при t 22°C pH>7, считаются щелочными, pH=7 - нейтральными, pH
Горная энциклопедия. — М.: Советская энциклопедия. Под редакцией Е. А. Козловского. 1984—1991.
- Водород
- Водосборная площадь
Смотреть что такое "Водородный показатель" в других словарях:
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — См. Активная реакция среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH) величина, характеризующая концентрацию (активность) ионов водорода в… … Экологический словарь
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — (рН) характеризует концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) водородных ионов ВОДОРОДНЫЙ цикл (протон протонная цепочка) цепочка термоядерных реакций… … Большой Энциклопедический словарь
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — (обозначается рН), показатель кислотности или щелочности раствора. Шкала водородных показателей выражает ряд значений рН, основанных на логарифмическом измерении концентрации, или активности, ионов водорода. Шкала включает значения от 0 до 14, а… … Научно-технический энциклопедический словарь
водородный показатель — Параметр, характеризующий концентрацию водородных ионов в растворе, т. е. степень его щелочности или кислотности. Показатель рН может изменяться от 0 до 14. Раствор, в котором рН равно семи, является нейтральным, ниже семи кислым, выше щелочным.… … Справочник технического переводчика
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — (pH), характеризует кислотность разбавленных растворов. Определяется как отрицательный десятичный логарифм концентрации ионов H+. В нейтральных водных растворах pH=7, в кислых <7, в щелочных >7 … Современная энциклопедия
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH) — Величина, характеризующая концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) ионов водорода [H+], выраженной в молях на литр: pH= lg[H+]. Водные растворы могут иметь … Словарь бизнес-терминов
Водородный показатель (Ph) — величина, характеризующая концентрацию ионов водорода; равна отрицательному десятичному логарифму концентрации ионов водорода. В нейтральной среде Ph = 7, в кислых средах < 7, в щелочных >7. В. п. бумаги характеризует ее стойкость к… … Издательский словарь-справочник
водородный показатель — Величина, характеризующая концентрацию иона водорода в растворах, а отсюда степень кислотности, широко используется для определения кислотности или щелочности почв. Syn.: индекс pH … Словарь по географии
водородный показатель pH — – отрицательный десятичный логарифм концентрации водородных ионов: pH = lg[H+]. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Водородный показатель — (pH), характеризует кислотность разбавленных растворов. Определяется как отрицательный десятичный логарифм концентрации ионов H+ . В нейтральных водных растворах pH=7, в кислых 7. … Иллюстрированный энциклопедический словарь
dic.academic.ru
Что такое ph и зачем о нем знать? — Блог Наталии Рыбиной

Можете ли вы себе представить, что развитие многих болезней зависит от одной причины? Многие специалисты диетологи и фитотерапевты эту скрытую опасность теперь обозначают двумя словами: кислота и щелочь.Высокая кислотность разрушает наиважнейшие системы в организме, и он становится беззащитен перед болезнями. Сбалансированная pH-среда обеспечивает нормальное протекание метаболических процессов в организме, помогая ему бороться с заболеваниями. Здоровый организм имеет запас щелочных веществ, которые он использует в случае необходимости.
Что такое pH?
Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием (КЩР), хотя физиологи считают, что более правильно называть это соотношение кислотно-щелочным состоянием. КЩР характеризуется водородным показателем pH (от лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш»), который показывает число водородных атомов в данном растворе.
Значение показателя pH зависит от соотношения между положительно заряженными ионами (формирующими кислую среду) и отрицательно заряженными ионами (формирующими щелочную среду).
PH — это мера относительной концентрации водородных (Н+) и гидроксильных (ОН—) ионов в жидкой системе и выражается в масштабе от 0 (полное насыщение ионами водорода Н+) до 14 (полное насыщение гидроксильными ионами ОН—), дистиллированная вода считается нейтральной с рН 7,0.0 — сильнейшая кислота, 14 — сильнейшая щелочь, 7 – нейтральное вещество.
Зачем нам знать о pH?
Тело человека на 80% состоит из воды, поэтому вода – это одна из наиболее важных его составляющих. Поэтому от того, какой водородный показатель (pH) будет у этой воды, зависит, насколько здоровы мы будем.
При pH равном 7,0 говорят о нейтральной среде. Чем ниже уровень pH – тем среда более кислая (от 6,9 до 0). Щелочная среда имеет высокий уровень pH (от 7,1 до 14,0).
Организм человека постоянно стремится уравновесить это соотношение, поддерживая строго определенный уровень pH. При нарушенном балансе могут возникать множество серьезных заболеваний.
Если в любой из жидкостных сред организма происходит повышение концентрации (Н+) ионов, то возникает смещение pH в кислую сторону, то есть, происходит закисление среды. Это называется ещё кислотным сдвигом.И наоборот — повышение концентрации (ОН-) ионов вызывает смещение значения pH в щелочную сторону, или щелочной сдвиг.Наш организм имеет слабощелочную среду. Кислотно-щелочной баланс в нашем организме постоянно поддерживается на одном стабильном уровне и в очень узком диапазоне: от 7,26 до 7,45. И даже незначительное изменение рН крови, выходящее за эти границы, может привести к болезням.
Повышенная кислотность в организме.
Из-за неправильного питания и употребления в пищу кислых продуктов, а также недостатка воды происходит закисление организма. Люди употребляют много жиров, мяса, молочных продуктов, зерновых культур, сахара, мучных и кондитерских изделий, всевозможных полуфабрикатов и других переработанных, рафинированных продуктов, практически не содержащих клетчатки, минералов и витаминов, не говоря уже о ферментах и ненасыщенных жирных кислотах.
Для того, чтобы противостоять этому – снизить концентрацию кислоты и удалить ее от жизненно важных органов – организм задерживает воду, что отрицательно влияет на обмен веществ: организм быстрее изнашивается, кожа становится сухой, морщинистой.
К тому же при закисленности организма ухудшается перенос кислорода к органам и тканям, организм плохо усваивает минералы, а некоторые минералы, такие как Ca, Na, K, Mg выводятся из организма.
Организму приходится тратить колоссальное количество ресурсов и энергии на нейтрализацию лишних кислот, вызывая тем самым определённый дисбаланс в биохимических реакциях.
Так как щелочных резервов, поступающих извне, явно не хватает, то организм вынужден задействовать свои внутренние ресурсы — кальций, магний, железо, калий. В результате снижается гемоглобин, развивается остеопороз.
Когда железо гемоглобина крови используется для нейтрализации кислоты, человек ощущает усталость.
Если на эти нужды расходуется кальций, появляется бессонница, раздражительность.
Вследствие снижения щелочного резерва нервной ткани нарушается умственная деятельность.
От недостатка минералов страдают жизненно важные органы, повышается риск сердечно сосудистых заболеваний, снижается иммунитет, появляется хрупкость костей и многое другое.
Если в организме находится большое количество кислоты и нарушены механизмы ее вывода (с мочой и калом, с дыханием, с потом и т.д.), организм подвергается сильнейшей интоксикации.
К чему приводит повышенный уровень кислотности в организме?
В глобальном масштабе, закисление организма приводит к возникновению более чем 200(!) заболеваний, например: катаракты, дальнозоркости, артрозов, хондрозов, желче- и мочекаменной болезней, и даже онкологии.Зная это, перестаешь удивляться, почему у человечества столько болезней, почему люди рано стареют и умирают.Вдумайтесь: более 90% пищи, которую мы едим — это «кислые» продукты, и всё, что мы пьем (кроме чистой воды, свежевыжатых соков и травяного чая без сахара) — имеет pH от 4,5 до 2,5 — то есть ещё больше закисляет наш организм.Состояние повышенной кислотности называется — Ацидоз. Не выявленный вовремя ацидоз может вредить организму незаметно, но постоянно в течение нескольких месяцев и даже лет. Злоупотребление алкоголем часто приводит к ацидозу. Ацидоз может возникать, как осложнение диабета.
При Ацидозе могут появиться следующие проблемы:
- Заболевания сердечно-сосудистой системы, включая стойкий спазм сосудов и уменьшение концентрации кислорода в крови, сердечная недостаточность, ослабление сердечной мышцы.
- Прибавление в весе и диабет.
- Заболевания почек и мочевого пузыря, образование камней.
- Проблемы с пищеварением, ослабление гладких мышц кишечника и так далее.
- Снижение иммунитета.
- Общая слабость.
- Увеличение вредного воздействия свободных радикалов, которые могут способствовать онкогенезу.
- Хрупкость костей вплоть, до перелома шейки бедра, а также других нарушениях опорно-двигательного аппарата, как например, образование остеофитов (шпор).
- Появление суставных болей и болевых ощущений в мышцах, связанных с накоплением молочной кислоты.
- Постепенное ослабление работы глазных мышц, развитие дальнозоркости, которая очень распространена среди пожилых людей.
- Снижение выносливости и способности восстанавливаться после физической нагрузки.
В течение 7 лет, проводилось исследование в Калифорнийском Университете (штат Сан-Франциско), где были обследованы 9 тыс. женщин. Результаты показали, что при постоянном повышенном уровне кислотности кости становятся ломкими.
Специалисты, проводившие этот эксперимент, уверены, что большинство проблем женщин среднего возраста связано с излишним употреблением мяса и молочных продуктов и недостатком употребления в пищу овощей, фруктов и зелени. Поэтому организму ничего не остается, как забирать кальций из собственных костей, и с его помощью регулировать уровень рН.
Как организм управляет уровнем кислотности?
- Выделяет кислоты — через желудочно-кишечный тракт, почки, легкие, кожу;
- Нейтрализует кислоты — с помощью минералов: кальций, магний, калий, натрий;
- Накапливает кислоты — в тканях, прежде всего в мышцах.
Отто Варбург потратил 24 года своей жизни на то, чтобы доказать тот факт, что в среде, насыщенной кислородом, при pH 7,43 и выше (слабощелочная среда), раковые клетки не размножаются. В 1932 году он получил за это Нобелевскую премию по химии. А его ученики позже доказали, что в этой среде НЕ развиваются паразиты, вирусы, бактерии и грибки.
Что делать, если pH-баланс в норме?
Ответ простой – способствовать сохранению этого баланса в здоровой зоне.
Как это сделать?
Постоянно контролировать, что мы едим, что мы пьем, насколько мы чистые изнутри и как мы защищаем свой организм от вредных воздействий.
Вода.Необходимо пить достаточное количество правильной воды, а конкретно — 30 мл на килограмм веса в день (в жаркие летние месяцы можно в 2-3 раза больше).Еда.Если кислотно щелочное равновесие уже нарушено, то стоит задуматься о своем питании, и уменьшить потребление кислой еды (мясных и молочных продуктов, хлеба, сладостей, газированных напитков, любых искусственно созданных продуктов) и увеличить потребление ощелачивающих продуктов. Если нет возможности изменить состав питания, то стоит задуматься об употреблении «умной еды» (smart food) — нутрицевтиков, восполняющих недостаток поступающих с пищей витаминов, минералов, аминокислот, полиненасыщенных жирных кислот и растительных ферментов.
Также нельзя забывать о регулярном очищении организма, двигательной активности и психологии позитивного отношения к жизни. Все это — части концепции здоровья, просто и доступно объясняющей причины большинства заболеваний и показывающей возможности восстановления и поддержания здоровья.
Молодеть и становиться более здоровым с годами — это реально!
Почему важно поддерживать правильный рН-баланс?
Слабокислая среда нужна для запуска разнообразных химических процессов (например, пищеварение — в желудке среда немного смещена в сторону кислотности), а вот кровь слабокислой быть не должна — если баланс pH в крови изменить, то процессы пойдут не так, как задумано.
Ведь в крови находится весь наш строительный материал (передаваемый из печени), белки, антитела, тучные гены, лейкоциты, питательные вещества и куча всего другого. Они настроены на работу именно в таком диапазоне (7.35-7.45) и малейший сдвиг работу всей системы нарушает (кровь же повсюду, у нас 85000 км вен и артерий но при этом всего 5 литров крови).
Все регулирующие механизмы организма (включая дыхание, обмен веществ, производство гормонов) направлены на уравновешивания уровня pH, путем удаления едких кислотных остатков из тканей организма, не повреждая живые клетки. Если уровень pH становится слишком низким (кислым) или слишком высоким (щелочным), то клетки организма отравляют сами себя своими токсичными выбросами и погибают.
Важность баланса всей этой системы подчёркивает ещё и такой факт: чтобы сохранить баланс между кислотой и щелочью, организм берёт кальций из костей (наш банк кальция) и магний (они с кальцием неразрывно связаны), чтобы ощелачивать кислоту.
Что делать хроникам?
Даже «самая правильная» программа питания, либо программа лечения каких либо болезней не будет эффективно работать, если ваш рН-баланс организма нарушен.
Постоянная нагрузка на компенсаторные системы организма в течение многих лет и десятилетий сильно вредит организму, изнашивает его. Постепенно и неуклонно происходит перекос в работе всех систем и обменных процессов.
Это не может продолжаться бесконечно и без последствий. Возникающие на этом фоне хронические заболевания просто невозможно вылечить с помощью медикаментов.
Здесь единственным и самым лучшим «лекарством» может быть только одно: полностью перестроить режим питания, ликвидировать кислотную нагрузку, питаться преимущественно сырой растительной пищей в течение многих лет — до тех пор, пока все функции, все процессы в организме не вернутся к нормальным параметрам и исчезнет дисбаланс.
Если человек понимает важность пересмотра питания, но по каким-то причинам у нег не получается строго следовать подобной диете, то в этом случае можно использовать ощелачивающие добавки к пище (smart food).
Чтобы жить полноценной, здоровой жизнью, единственный выход – это ощелачивание организма.
То, как мы будем это делать, зависит полностью от нашего выбора. Кто-то сможет полностью следовать советам по изменению пищевого рациона и станет веганом или сыроедом. А кто-то (как я, например) столкнется с тем, что для него это сложно.
И тогда возникнет вопрос:
А ЧТО ЖЕ ДЕЛАТЬ МНЕ, ОБЫЧНОМУ ЧЕЛОВЕКУ?
Я выбрала для себя систему восстановления кислотно-щелочного равновесия от Кораллового Клуба (Coral Club) и достаточно долгий срок с успехом применяю ее в своей жизни. За это время мой организм изменился и внешне, и внутренне.
Подробнее самой простой и безопасной программе ощелачивания здесь.
Если Вас заинтересовала эта система и Вы хотите узнать о ней больше или начать применять ее как можно скорее — свяжитесь со мной любым удобным для Вас способом, чтобы получить подробную консультацию.
Источник части текста
n-rybina.ru
Уровень pH в воде. Как его повысить или понизить? Кислотность воды
Уровень pH в воде. Как его повысить или понизить?

Понятие pH было впервые применено в 1909 году. Датский химик Серенсен ввел pH для обозначения силы (веса) водорода. pH происходит от первых букв двух латинских слов – potentia hydrogeni. На сегодняшний день нередко слышишь слово «пэ аш» в обиходе.
Самые основные значения pH:
- чистая вода имеет значение 7,0 pH;
- шампунь для волос – 5,5 pH;
- здоровая человеческая кожа – ориентировочно 6,5 pH;
- морская вода – 8,0 pH;
- жидкое мыло для рук – 9,0 – 10,0.
С pH уровнем связано множество явлений не только в жизни человека, но и в самой природе. К примеру, некоторые виды рыб могут жить только в воде, где уровень pH не ниже 5,5 и не выше 10. А вот организм человека менее чувствителен к уровню pH. Мы усваиваем пищу с самыми разными значениями pH. Знаменитая Кока-Кола имеет pH в 2,3 единицы – это по сути практически кислота, а томатный сок 4,0 pH. Питьевая вода выходит из под-крана в городских квартирах в диапазоне от 5,5 до 10. В каждой стране показатель pH воды различен, но находится под строгим наблюдением со стороны компетентных органов.
Значение pH можно проанализировать посредством специальных приборов или используя лакмусовый индикатор. Уровень pH вполне можно изменять за счет добавления в воду определенных солей. Тот же гирдрокарбонат кальция повышает уровень pH, а вот если речь идет о питьевой воде, то понизить уровень pH можно посредством использования обычных фильтров для воды. pH бывает только в растворах или в расплавленном виде, в твердых веществах pH отсутствует и может проявиться только в случае распада вещества на ионы.
Уровень pH в воде. Как его повысить или понизить? Когда речь идет о регулировании уровня pH в воде, то в первую очередь подразумевается вода в бассейнах и аквариумах для содержания рыб. Уровень pH не столь важен для мытья головы или стирки белья, но для некоторых видов гигиенических процедур требуется особое внимание к данному показателю.
Привести в норму pH в бассейне является основной задачей. Причем установить оптимальный pH необходимо еще до момента использования дезинфицирующих средств, в частности хлора. Норма pH для бассейнов – 7,2-7,6 единиц. Чтобы точно знать об уровне pH, необходимо использование специального прибора – тестера. В продаже имеются таблеточные, индикаторные, капельные и электронные. При слишком повышенном значении уровня pH в бассейне (более 7,6 единиц) вода считается излишне щелочной. В результате после купания может появиться кожный зуд, сыпь, раздражение слизистых оболочек. При этом высокий уровень pH приводит к снижению действия дезинфицирующих средств. Итогом может быть дискомфорт во время водных процедур, а также необходимость использования дезсредств в намного большем объеме, чем обычно.
При слишком низком уровне pH (ниже 7,2) вода в бассейне считается кислотной. Вода с таким показателем будет активно разрушать поверхность бассейна и металлические части оборудования для бассейна.
Чтобы отрегулировать pH воды используются специальные средства, повышающие или понижающие pH в воде. Если уровень pH повышен или повышен, то следует обязательно его отрегулировать. Не стоит закрывать глаза на этот показатель, ведь именно от него зависит комфорт и удовольствие от водных процедур в бассейне.
www.watermap.ru
Регулировка рН (пэ аш) воды бассейна
А надо ли? Сосед никогда не использует и говорит, что все нормально. Так и «наша обувь хороша– большой палец устал показывать. Это если не видел другой» как говорил М. Жванецкий. Поэтому, надо регулировать рН. Если попытаться просчитать здесь все выгоды в деньгах, то вы запутаетесь и не станете дальше считать. Поэтому перечисляю только почему надо (принято за норму 7,2-7,4рН):• кислая среда (ниже 7) – усиленная коррозия оборудования и материалов, раздражение слизистой. Щелочная среда (выше 7,8) – сухость кожи, раздражающее пощипывание или покалывание.• большая часть химии, особенно хлор, активна в слабокислой среде. При рН больше 7,4 значительная часть хлора работает на побочные реакции и не участвует в дезинфекции воды. Вот почему знатоки перед шоковым хлорированием даже опускают рН.• при повышенном рН цвет воды стремится к бирюзовому, при понижении рН к голубому.• повышенный рН благоприятствует водорослевому заражению и помутнению воды.На вопрос можно ли обойтись без регулировки рН у меня есть отдельная статья. Читайте.Теперь о самом регуляторе рН. Их два вида и они продаются в двух состояниях. Для снижения рН применяют, так называемый, рН-минус. Он продается в жидком состоянии и в твердом. В твердом, это кислый сернокислый натрий. Растворяясь в воде, он преобразуется в серную кислоту. Не пугайтесь. Вы же не дрожите как осиновый листок от того, что у вас в желудочном соке соляная кислота? И тут нет ничего страшного при этих концентрациях. Естественно, ее количество не равно весу взятой соли, а много меньше. Поэтому просто сравнивать стоимость твердого (порошкового) рН-минуса с жидким бессмысленно. Надо писать уравнения, учитывать концентрацию, расход и цену.
Для снижения рН применяют, так называемый, рН-минус. Он продается в жидком состоянии и в твердом. В твердом, это кислый сернокислый натрий. Растворяясь в воде, он преобразуется в серную кислоту. Не пугайтесь. Вы же не дрожите как осиновый листок от того, что у вас в желудочном соке соляная кислота? И тут нет ничего страшного при этих концентрациях. Естественно, ее количество не равно весу взятой соли, а много меньше. Поэтому просто сравнивать стоимость твердого (порошкового) рН-минуса с жидким бессмысленно. Надо писать уравнения, учитывать концентрацию, расход и цену. Жидкий рН-минус это раствор серной кислоты или соляной. Как мы знаем, растворы бывают разной концентрации. Поэтому можно купить и низко концентрированный раствор, но за большие деньги. Это уже искусство продавца и ваше не умение анализировать. Растворы серной кислоты обычно продают от 50 до 35%, соляной 15-17%. К примеру, концентрированная соляная кислота имеет 36%, она дымится и от ее паров можно получить шок. Из этого следует, что рН-минуса на основе солянки пойдет больше, чем на основе серной. Значит, стоит сопоставить цены при покупке. И рН-минус на солянке реже используют из-за ее высокой летучести (быстро испаряется) и коррозионных свойств паров.Возникает вопрос, так что же выгоднее использовать, твердый или жидкий рН-минус? Вопрос требует расчета для разных ситуаций. Давайте в следующий раз подумаем об этом вместе.Для повышения рН используют, так называемый, рН-плюс. Он продается в жидком состоянии и в твердом. В твердом, это смесь основной и кислой солей карбоната натрия. У этого реагента есть еще одно очень важное свойство кроме как повысить рН. Эти две соли создают в воде буферную емкость и такая вода активно сопротивляется колебаниям рН под воздействием внешних факторов. А жидкий рН-плюс это всего лишь 25% — ный раствор тех же солей. И опять хочется спросить, так что же выгоднее использовать, твердый или жидкий рН-плюс? Вопрос требует расчета для разных ситуаций. Давайте в следующий раз подумаем об этом вместе. Однозначно можно сказать только, что если у вас дозатор жидкой химии, то надо пользоваться раствором. И в случае рН-плюса вы его легко сможете приготовить сами.
Жидкий рН-минус это раствор серной кислоты или соляной. Как мы знаем, растворы бывают разной концентрации. Поэтому можно купить и низко концентрированный раствор, но за большие деньги. Это уже искусство продавца и ваше не умение анализировать. Растворы серной кислоты обычно продают от 50 до 35%, соляной 15-17%. К примеру, концентрированная соляная кислота имеет 36%, она дымится и от ее паров можно получить шок. Из этого следует, что рН-минуса на основе солянки пойдет больше, чем на основе серной. Значит, стоит сопоставить цены при покупке. И рН-минус на солянке реже используют из-за ее высокой летучести (быстро испаряется) и коррозионных свойств паров.Возникает вопрос, так что же выгоднее использовать, твердый или жидкий рН-минус? Вопрос требует расчета для разных ситуаций. Давайте в следующий раз подумаем об этом вместе.Для повышения рН используют, так называемый, рН-плюс. Он продается в жидком состоянии и в твердом. В твердом, это смесь основной и кислой солей карбоната натрия. У этого реагента есть еще одно очень важное свойство кроме как повысить рН. Эти две соли создают в воде буферную емкость и такая вода активно сопротивляется колебаниям рН под воздействием внешних факторов. А жидкий рН-плюс это всего лишь 25% — ный раствор тех же солей. И опять хочется спросить, так что же выгоднее использовать, твердый или жидкий рН-плюс? Вопрос требует расчета для разных ситуаций. Давайте в следующий раз подумаем об этом вместе. Однозначно можно сказать только, что если у вас дозатор жидкой химии, то надо пользоваться раствором. И в случае рН-плюса вы его легко сможете приготовить сами.
obasseyne.info