Принципы классификации белков. Классы, общая характеристика. Основные отличия между альбуминами и глобулинами, протаминами и гистонами. Альбумины и гистоны
Характеристика простых белков (альбумины, глобулины, гистоны, протамины). Отметьте особенности их строения и функции.
⇐ ПредыдущаяСтр 5 из 8Следующая ⇒Структура простых белков представлена только полипептидной цепью(альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в "чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам только по той причине, что связи с небелковой группой слабые.
Альбумины Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 кДа, содержат много глутаминовой кислоты и поэтому имеют кислыесвойства и высокий отрицательный зарядпри физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортеромв крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот.
Глобулины Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислыеилинейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая,Вельтмана). Часто содержат углеводные компоненты.
При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины,α2-глобулины, β-глобулины и γ-глобулины.
Гистоны
Гистоны – внутриядерные белки массой около 24
кДа. Обладают выраженными основными
свойствами, поэтому при физиологических
значениях рН заряжены положительно и
связываются с дезоксирибонуклеиновой
кислотой (ДНК),
образуя дезоксирибонуклеопротеины.
Существуют 5 типов гистонов – очень богатый
лизином (29%) гистон Н1, другие гистоны Н2а,
h3b, НЗ, Н4 богаты лизином и аргинином (в сумме
до 25%).
Радикалы аминокислот в составе гистонов могут
быть метилированы, ацетилированы или
фосфорилированы. Это изменяет суммарный
заряд и другие свойства белков.
Можно выделить две функции гистонов:
1. Регуляция активности генома, а именно – они препятствуют транскрипции.
2. Структурная– стабилизируют пространственную структуру ДНК.
Гистоны в комплексе с ДНК образуют нуклеосомы– октаэдрические структуры, составленные из
гистонов Н2а, h3b, НЗ, Н4. Между нуклеосомами располагается гистон h2, также связанный с
молекулой ДНК. ДНК обвивает нуклеосому 2,5 раза и переходит к гистону h2, после чего обвивает
следующую нуклеосому. Благодаря такой структуре достигается уменьшение размеров ДНК в 7 раз.
Далее нить ДНК с нуклеосомами складывается в суперспираль___________и суперсуперспираль. Таким
образом, гистоны участвуют в плотной упаковке ДНК при формировании хромосом. Например,
благодаря гистонам в конечном итоге размеры ДНК уменьшаются в тысячи раз: длина ДНК достигает
6-9 см (10-1), а размеры хромосом – всего несколько микрометров (10-6).
Протамины
Это белки массой от 4 кДа до 12 кДа, у ряда организмов (рыбы) они являются заменителями гистонов,
есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины
присутствуют в клетках, не способных к делению. Их функция как у гистонов – структурная.
13. Характеристика и особенности строения классов сложных белков:
mykonspekts.ru
Характеристика простых белков (альбумины, глобулины, гистоны, протамины)
Существенным фактором в изменении чувствительности организма к инсулину является изменение функционального состояния внепанкреатических механизмов — коры головного мозга, высших вегетативных нервных центров, гипофиза, надпочечников. Это заключение основывается на получении перестройки реакции у больных с очень тяжелой формой диабета, со стойко державшейся высокой гипергликемией натощак, когда нельзя предположить повышение функции рстровкового аппарата.
Подобное значительное повышение чувствительности к инсулину в результате повторных гипогликемических состояний удается получить у собак с полным удалением поджелудочной железы.
Большим упрощением инсулинотерапии сахарного диабета явилось получение препаратов инсулина с длительным действием. Первым из препаратов этого типа был протамин-инсулин, а затем гистон-инсулин — соединение инсулина с дериватами белка. Эти препараты ввиду плохой растворимости вводились в виде эмульсии.
Растворимость их в тканевой жидкости была несколько лучше, чем в воде, но тоже недостаточная, что обусловливало медленное их всасывание. Это объясняло длительность эффекта почти в 2 раза большую, чем при введении обычного инсулина.
В результате дальнейших работ было достигнуто значительное удлинение действия протамин-ипсулииа путем прибавления к нему цинка. Это наблюдение было положено в основу приготовления препаратов протамип-цинк-инсулииа, а также трипротамин-цинк-инсулина, действие которых продолжается больше суток. При их введении рано утром сахар крови ночью и на другой день утром держится еще на низком уровне и даже могут наблюдаться ночные гипогликемии. Такое удлинение действия этого препарата дает возможность обойтись одной инъекцией.

Однако полное действие трипротамин-цинк-инсулина и протамин-цинк-инсулина на сахар крови и мочи наступает приблизительно через 8 часов после его введения, т. е. значительно позже, чем при введении обыкновенного инсулина. Эта особенность их действия требует перестройки питания. Прием углеводов необходимо производить 4—5 раз в течение суток: сразу, когда больной утром просыпается, затем через каждые 4—5 часов после инъекции и непосредственно перед сном. Вопрос о содержании продуктов, богатых углеводами, во время завтрака через 4—5 часов после инъекции можно решить на основании анализов сахара мочи в этот промежуток времени.
Вводится трипротамин-цинк-инсулин и протамин-цинк-инсулин или в ранние утренние часы (7—9 часов), или перед сном (22—24 часа). Для решения вопроса о дозировке препаратов при утреннем введении необходимо следить за сахаром крови натощак, выделением его в суточной моче и отдельно исследовать ночную и утренюю порции мочи.
Если сахар крови натощак снижается до уровня 120—150 мг%, а также если устраняется сахар в ночной или ранней утренней моче, дозу инсулина надо сократить на 4—8 ед. в зависимости от ее величины и уровня гликемии натощак. Анализ ночной или ранней утренней порции мочи на сахар является, конечно, более доступным исследованием для изменения дозы инсулина.
При применении трипротамин-цинк-инсулина и протамин-цинк-инсулина значительная гипергликемия и гликозурия могут держаться в течение первых 8 часов после их введения. Повышение доз может повести к гипогликемическому синдрому в поздние часы, не устраняя гипергликемии и гликозурии в первые часы после инъекции. В этих случаях приходится комбинировать одновременное введение трипротамин-цинк-инсулина и протамин-цинк-инсулипа с небольшими дозами обыкновенного инсулина, постепенно повышая эти дозы под контролем определения сахара мочи; нельзя, однако, смешивать препараты в одном шприце.
При введении препаратов длительного действия перед сном для избежания гипогликемии необходимо особенно следить за содержанием сахара в дневной и вечерней моче и при устранении сахара в этих порциях мочи производить понижение дозы на 4—8 ед. Добавление простого инсулина при вечернем введении этих препаратов следует производить в те часы, когда установлено систематическое появление гликозурии. Надо помнить также, что гипогликемическая реакция при трипротамин-цинк-инсулине и протамин-цинк-инсулине может протекать менее типично, чем при обыкновенном инсулине,— она наступает более постепенно.
Нередко трудно распознается больными и иногда впервые проявляется наступлением бессознательного состояния. Опасность тяжелой гипогликемии особенно велика в ночные часы (при утренней инъекции), когда действие трипротамин-цинк-инсулина и протамин-цинк-инсулина активно, а углеводов больной не получает. Вызванное этими препаратами гипогликемическое состояние может повторяться и после его устранения. Вследствие этого после устранения гипогликемии, вызванной три-протамин-цинк-инсулином и протамин-цинк-инсулином, надо повторно давать пищу, богатую углеводами.
Рекомендуемое нашими посетителями:
Ждем ваших вопросов и рекомендаций:
Материалы подготовлены и размещены посетителями сайта. Ни один из материалов не может быть применен на практике без консультации лечащего врача.
Материалы для размещения принимаются на указанный почтовый адрес. Администрация сайта сохраняет за собой право на изменение любой из присланных и размещенных статей, в том числе полное удаление с проекта.
Материалы: http://medicalplanet.su/Patfiz/1425.html
vekoff.ru
Простые белки. Принцип их классификации. Глобулярные белки. Функции альбуминов и глобулинов плазмы крови. Особенности строения и функция гистонов и протаминов.
К простым белкам относят гистоны, протамины, альбумины, глобулины, проламины, глютелины и протеиноиды (или склеропротеины).
Простые белкисостоят только из остатков аминокислот и при гидролизе распадаются на свободные аминокислоты.
Сложные белки двухкомпонентны: состоят из простого белка и небелковой части (простетической группы). Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные структуры белка). Это одна из самых старых классификаций, которая делит белки на 2 группы: глобулярные и фибриллярные.К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. К глобулярным белкам относятся:
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Альбумины и глобулины.
Альбумины - простые белки; входят в состав животных и растительных тканей; содержатся в белке яиц, сыворотке крови, молоке, в семенах растений. Растворимы в воде, солевых растворах, кислотах и щелочах. Примерно 75-80% осмотического давления белков сыворотки крови приходится на альбумины. Они выполняют также функцию транспорта жирных кислот.
Глобулины - группа животных и растительных белков, широко распространённых в природе. Растворимы в слабых растворах нейтральных солей, разбавленных кислотах и щелочах. Глобулины, представленные a-фракцией, содержатся в крови в комплексе с билирубином и с липопротеинами высокой плотности. Фракция β-глобулинов включает протромбин, являющийся предшественником тромбина - белка, участвующего в свертывании крови. Фракция g-глобулинов наиболее гетерогенная. Важнейшие g-глобулины - иммуноглобулины.
В плазме крови человека в норме содержится около 7% белков, представленных преимущественно альбуминами и глобулинами. Отношение альбумин/глобулин имеет диагностическое значение: в норме оно близко к 2, а при воспалительных заболеваниях - уменьшается.
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются сдезоксирибонуклеиновой кислотой(ДНК), образуя дезоксирибо-нуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, h3b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%).
Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков.
Можно выделить две функции гистонов:
1. Регуляция активности генома, а именно – они препятствуют транскрипции.
2. Структурная– стабилизируют пространственную структуру ДНК.
Гистоны в комплексе с ДНК образуют нуклеосомы– октаэдрические структуры, составленные из гистонов Н2а, h3b, НЗ, Н4. Между нуклеосомами располагается гистон h2, также связанный с молекулой ДНК. ДНК обвивает нуклеосому 2,5 раза и переходит к гистону h2, после чего обвивает следующую нуклеосому. Благодаря такой укладке достигается уменьшение размеров ДНК в 7 раз.
Далее такие "бусы" нуклеосом могут складываться в суперспираль и более сложные структуры.
Протамины
Это белки массой от 4 кДа до 12 кДа, у ряда организмов (рыбы) они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины присутствуют в клетках, не способных к делению. Их функция как у гистонов –структурная.
Сложные белки, их классификация. Металлопротеины и их функция в организме. Гликопротеины, строение простетической группы, биологическая роль. Коллаген.
Сложные белки двухкомпонентны: состоят из простого белка и небелковой части (простетической группы).
cyberpedia.su
Принципы классификации белков. Классы, общая характеристика. Основные отличия между альбуминами и глобулинами, протаминами и гистонами.
По составу белки можно разделить на простые и сложные, первые содержат в молекуле только аминокислоты, вторые — еще и другие структуры (добавочные или простетические группы).
Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные.
Глобулярные белки отличаются шарообразной формой молекулы (эллипсоид вращения), растворимы в воде и в разбавленных солевых растворах. Хорошая растворимость объясняется локализацией на поверхности глобулы заряженных аминокислотных остатков, окруженных гидратной оболочкой, что обеспечивает хороший контакт с растворителем. К этой группе относятся все ферменты и большинство других биологически активных белков, исключая структурные.
Среди глобулярных белков можно выделить'
1) альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
2) полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
3) гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
4) протамины отличаются еще более высоким содержанием аргинина (до 85%), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
5) проламины характеризуются высоким содержанием глутаминовой кислоты (30-45%) и пролина (до 15%), нерастворимы в воде, растворяются в 50-90%—яом этаноле;
6) глутелины содержат около 45% глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически не растворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании, структурных элементов соединительной ткани (коллагены, кератины, эластины).
Сложные белки (протеиды) содержат наряду с протеиногенными аминокислотами органический или неорганический компонент иной природы — простетическую группу. Она связана с полипептидной цепью ковалентно, гетеропо-лярно или координационно. Важнейшие представители: гликопротеины (нейтральные сахара, аминосахара, кислые производные моносахаридов), липопротеины (триацилглицериды, фосфолипиды и холестерол), металлопротеины (ион металла, связанный ионной или координационной связью), фосфопротеины (остатки фосфорной кислоты, связанные через остаток серина или треонина), нуклеопротеины (нуклеиновые кислоты), хромопротеины (окрашенный компонент — пигмент или хромоген).
Важнейший хромопротеид — гемоглобин.
Нуклеопротеиды — соединения, молекула которых состоит из простого белка и нуклеиновой кислоты: дезоксирибонуклеиновой (ДНК) или рибонуклеиновой (РНК).
ДНК — неразветвленный полимер, образованный из связанных между собой нуклеотидов, содержащих дезоксирибозу. Нуклеотид включает одно из четырех азотистых оснований (аденин (А), тимин (Т), гуанин (Г) или цитозин (Ц), остаток рибозы и фосфорной кислоты (Р). Нуклеотиды в полимере соединены между собой через остаток фосфорной кислоты, образующей эфирную связь с С-3 в остатке рибозы предшествующего нуклеотида .
Для ДНК всех видов клеток характерно равенство между количеством остатков аденина и тимина (А = Т), гуанина и цитозина (Г = Ц) — правил Чаргаффа, т.е. число пуриновых оснований равно числу пиримидиновыз Отношение А + Т к Г + Ц варьирует у разных видов в широких пределах -от 0,35 до 2,70.
Относительно друг друга цепи расположены так, что пуриновому основанию в одной из них соответствует пиримидиновое основание в другой. Эти основания комплементарны друг к другу, т.е. пространственно взаимодополняют одна другую.
В молекуле основания связаны водородными мостиками' двумя между А и Т и тремя — между Ц и Г .
ДНК ядра животных клеток представляет собой не одну молекулу, а состоит из многих, распределенных по разным (у человека по 46) хромосомам. Как уже сказано, по первичной структуре, т.е. набору нуклеотидов, во всех клетках организма ДНК совершенно одинакова, в том числе и в специализированных клетках, но отличается по характеру белкового компонента.
РНК в отличие от ДНК, которая находится преимущественно в ядре, содержится в основном в цитоплазме, главным образом в рибосомах (это определяет их название), в небольшом количестве — в ядрах, главным образом
— ядрышках.
Сходна по первичной структуре с ДНК, отличаясь следующим:
1) вместо дезоксирибозы содержит рибозу;
2) вместо тимина — урацил (тимин присутствует в очень малых количествах).
Как и ДНК, РНК — это полимерная цепь, построенная по аналогичному Принципу, не обладает строгой упорядоченностью вторичной структуры (спи-рализованные участки менее протяженны, чем в ДНК, местами образует петли, на протяжении которых азотистые основания связаны водородными мостиками по принципу комп-лементарности в пределах одной цепи (рис.13).
В отличие от ДНК рибонуклеиновые кислоты разнообразны. Наиболее тяжелые происходят из рибосом — рибосомные РНК. Внутри растворимой клеточной фракции содержится растворимая РНК или транспортная (функциональное название). Третья разновидность — информационные РНК.
Рибосомные РНК (р-РНК) связаны с белками рибосомы, представленными десятками разновидностей в пределах одной и той же рибосомы.
Гемоглобин (НЬ) — важнейший хромопротеид, обладающий уникальной функцией
— перенос кислорода и углекислоты.
Белковый компонент НЬ — глобин, небелковый — гем. Структура НЬ неодинакова у разных видов и может иметь варианты у одного вида или одной особи. Отличия касаются белковой части — последовательности аминокислот. Структура гема идентична у всех позвоночных.
Молекула глобина содержит четыре полипептидные цепи, которые удерживаются вместе нековалентными связями. Гемоглобин А — основной гемоглобин взрослого человека— состоит из двух видов поли-пептидных цепей — а и р. О разновидностям гемоглобина, связанных с вариантами структуры глобина, мы будем говорить ниже.
Последовательности аминокислот в НЬА (вообще в гемоглобине 20 видов животных) расшифрованы полностью
Гем — молекула, построенная из четырех гетероциклов, содержащих азот — пиррольных колец.
Остатки пиррола соединены в молекуле гема по а-углеродным атомам метиновыми мостиками (-СН=), [3-углеродные атомы замещены в пиррольных кольцах метильными группами (4), винильными {2) и остатками пропионовой кислоты (2).
С атомами азота пиррольных колец в геме связан ион двувалентного железа. Кроме того, железо взаимодействует с атомом азота в остатках гистидина (Гис 87 а-субъединицы, Гис 92 [3-субъединицы). С белковой частью молекулы гем связан еще и электростатическим взаимодействием через пропиониловые остатки. Со стороны белка в этих связях участвуют остатки основных аминокислот (лизин, аргинин).
cyberpedia.su
Билет 5
Принципы классификации белков. Классы, общая характеристика. Основные отличия между альбуминами и глобулинами, протаминами и гистонами.
По составу белки можно разделить на простые и сложные, первые содержат в молекуле только аминокислоты, вторые — еще и другие структуры (добавочные или простетические группы).
Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные.
Глобулярные белки отличаются шарообразной формой молекулы (эллипсоид вращения), растворимы в воде и в разбавленных солевых растворах. Хорошая растворимость объясняется локализацией на поверхности глобулы заряженных аминокислотных остатков, окруженных гидратной оболочкой, что обеспечивает хороший контакт с растворителем. К этой группе относятся все ферменты и большинство других биологически активных белков, исключая структурные.
Среди глобулярных белков можно выделить'
1) альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
2) полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
3) гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
4) протамины отличаются еще более высоким содержанием аргинина (до 85%), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
5) проламины характеризуются высоким содержанием глутаминовой кислоты (30-45%) и пролина (до 15%), нерастворимы в воде, растворяются в 50-90%—яом этаноле;
6) глутелины содержат около 45% глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически не растворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании, структурных элементов соединительной ткани (коллагены, кератины, эластины).
Сложные белки (протеиды) содержат наряду с протеиногенными аминокислотами органический или неорганический компонент иной природы — простетическую группу. Она связана с полипептидной цепью ковалентно, гетеропо-лярно или координационно. Важнейшие представители: гликопротеины (нейтральные сахара, аминосахара, кислые производные моносахаридов), липопротеины (триацилглицериды, фосфолипиды и холестерол), металлопротеины (ион металла, связанный ионной или координационной связью), фосфопротеины (остатки фосфорной кислоты, связанные через остаток серина или треонина), нуклеопротеины (нуклеиновые кислоты), хромопротеины (окрашенный компонент — пигмент или хромоген).
Важнейший хромопротеид — гемоглобин.
Нуклеопротеиды — соединения, молекула которых состоит из простого белка и нуклеиновой кислоты: дезоксирибонуклеиновой (ДНК) или рибонуклеиновой (РНК).
ДНК — неразветвленный полимер, образованный из связанных между собой нуклеотидов, содержащих дезоксирибозу. Нуклеотид включает одно из четырех азотистых оснований (аденин (А), тимин (Т), гуанин (Г) или цитозин (Ц), остаток рибозы и фосфорной кислоты (Р). Нуклеотиды в полимере соединены между собой через остаток фосфорной кислоты, образующей эфирную связь с С-3 в остатке рибозы предшествующего нуклеотида .
Для ДНК всех видов клеток характерно равенство между количеством остатков аденина и тимина (А = Т), гуанина и цитозина (Г = Ц) — правил Чаргаффа, т.е. число пуриновых оснований равно числу пиримидиновыз Отношение А + Т к Г + Ц варьирует у разных видов в широких пределах -от 0,35 до 2,70.
Относительно друг друга цепи расположены так, что пуриновому основанию в одной из них соответствует пиримидиновое основание в другой. Эти основания комплементарны друг к другу, т.е. пространственно взаимодополняют одна другую.
В молекуле основания связаны водородными мостиками' двумя между А и Т и тремя — между Ц и Г .
ДНК ядра животных клеток представляет собой не одну молекулу, а состоит из многих, распределенных по разным (у человека по 46) хромосомам. Как уже сказано, по первичной структуре, т.е. набору нуклеотидов, во всех клетках организма ДНК совершенно одинакова, в том числе и в специализированных клетках, но отличается по характеру белкового компонента.
РНК в отличие от ДНК, которая находится преимущественно в ядре, содержится в основном в цитоплазме, главным образом в рибосомах (это определяет их название), в небольшом количестве — в ядрах, главным образом
— ядрышках.
Сходна по первичной структуре с ДНК, отличаясь следующим:
1) вместо дезоксирибозы содержит рибозу;
2) вместо тимина — урацил (тимин присутствует в очень малых количествах).
Как и ДНК, РНК — это полимерная цепь, построенная по аналогичному Принципу, не обладает строгой упорядоченностью вторичной структуры (спи-рализованные участки менее протяженны, чем в ДНК, местами образует петли, на протяжении которых азотистые основания связаны водородными мостиками по принципу комп-лементарности в пределах одной цепи (рис.13).
В отличие от ДНК рибонуклеиновые кислоты разнообразны. Наиболее тяжелые происходят из рибосом — рибосомные РНК. Внутри растворимой клеточной фракции содержится растворимая РНК или транспортная (функциональное название). Третья разновидность — информационные РНК.
Рибосомные РНК (р-РНК) связаны с белками рибосомы, представленными десятками разновидностей в пределах одной и той же рибосомы.
Гемоглобин (НЬ) — важнейший хромопротеид, обладающий уникальной функцией
— перенос кислорода и углекислоты.
Белковый компонент НЬ — глобин, небелковый — гем. Структура НЬ неодинакова у разных видов и может иметь варианты у одного вида или одной особи. Отличия касаются белковой части — последовательности аминокислот. Структура гема идентична у всех позвоночных.
Молекула глобина содержит четыре полипептидные цепи, которые удерживаются вместе нековалентными связями. Гемоглобин А — основной гемоглобин взрослого человека— состоит из двух видов поли-пептидных цепей — а и р. О разновидностям гемоглобина, связанных с вариантами структуры глобина, мы будем говорить ниже.
Последовательности аминокислот в НЬА (вообще в гемоглобине 20 видов животных) расшифрованы полностью
Гем — молекула, построенная из четырех гетероциклов, содержащих азот — пиррольных колец.
Остатки пиррола соединены в молекуле гема по а-углеродным атомам метиновыми мостиками (-СН=), [3-углеродные атомы замещены в пиррольных кольцах метильными группами (4), винильными {2) и остатками пропионовой кислоты (2).
С атомами азота пиррольных колец в геме связан ион двувалентного железа. Кроме того, железо взаимодействует с атомом азота в остатках гистидина (Гис 87 а-субъединицы, Гис 92 [3-субъединицы). С белковой частью молекулы гем связан еще и электростатическим взаимодействием через пропиониловые остатки. Со стороны белка в этих связях участвуют остатки основных аминокислот (лизин, аргинин).
studfiles.net
КЛАССИФИКАЦИЯ БЕЛКОВ
9
Креатинфосфокиназа - фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц - В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ.Всего 3 изофермен-
та.
А. ПО ФУНКЦИИ
См выше "Функции белков"
Б. ПО СТРОЕНИЮ
1.По форме молекулы:
Глобулярные – соотношение про-
дольной и поперечной осей составляет
<10 и в большинстве случаев не более 3-4.Они характеризуются компактной ук-
ладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови.
Фибриллярные – соотношение осей >10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции.
Например: кератин, миозин, коллаген, фибрин.
2.По количеству белковых цепей в одной молекуле
•мономерные – имеют одну субъединицу (протомер)
•полимерные – имеют несколько субъединиц.
Например, гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинфосфокиназа
(2 субъединицы), РНК-полимеразаE.coli (5 цепей),аспартаткарбамоил-трансфераза(12 протоомеров), пируватдегидрогеназа (72 цепи).
3. По химическому составу:
Простые – содержат в составе только аминокислотыСложные – кроме аминокислот имеются небелковые компоненты
ПРОСТЫЕ БЕЛКИ
Структура представлена только полипептидной цепью (альбумин, инсулин).
Однако необходимо понимать, что многие простые белки (например, альбумин) не
существуют в „чистом" виде, просто связи с небелковой группой слабые.
10
Альбумины
Белки массой ММ=40кД, имеют кислые свойства и отрицательный заряд при физиологических рН, т.к. содержат много глутаминовой кислоты. Легко адсорбируют
полярные и неполярные молекулы, является в крови переносчиком многих веществ
Глобулины – ММ>100 кД, слабокислые или нейтральные, поэтому они слабо гидратированы, менее устойчивы и легче осаждаются, что используется в клиниче-
ской диагностике в „осадочных" пробах (тимоловая, Вельтмана). Часто содержат уг-
леводные компоненты. Некоторые способны к связыванию определенных веществ: трансферрин (переносчик Fe), церулоплазмин (переносчик Си), гаптоглобин (пере-
носчик гемоглобина), гемопексин (переносчик тема). При электрофорезе разделяют-
ся, как минимум, на 4 фракции а1, а2, в и у.
Гистоны
Белки массой ММ=24 кД. Обладают выраженными основными свойствами, т.е. при физиологических рН заряжены положительно и, поэтому связываются с ДНК.
Существуют 5 типов гистонов:
•Н1 – очень богат Лиз (29%),
•Н2а – умеренно богат Лиз (11%)
иApr (9,5%),
•h3b – умеренно богат Лиз (16%)
иApr (6,5%),
•НЗ – умеренно богат Лиз (10%) и
Apr (13,5%),
•Н4 – умеренно богат Лиз (11%) и
Apr (14%).
Радикалы аминокислот в составе
гистонов могут быть ферментативно метилированы, ацетилированы или фосфо-
рилированы. Это изменяет суммарный
заряд и другие свойства белков.
Функция:
1.Регулируют активность генома, а именно
–препятствуют транскрипции,
2.Структурная – стабилизируют простран-
ственную структуру ДНК.
Гистоны образуют нуклеосомы (укорочение в 7 раз), далее суперспираль и „суперсу-
перспираль". Тем самым они участвуют в плотной упаковке ДНК при формировании
хромосом. Благодаря гистонам размеры ДНК
уменьшаются в тысячи раз: ведь длина ДНК достигает 6-9см(10-1),а размеры хромосом –
всего несколько микрометров (10-6)
Протамины
Это белки массой ММ=4-12кД, у ряда организмов они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина
(до 80%). Функция – структурная.
11
Коллаген
Фибриллярный белок с уникальной структурой. Обычно содержит моносахаридные (галактоза) и дисахаридные (галактоза-глюкоза)остатки, соединенные с ОН-
группами некоторых остатков гидроксилизина. Составляет основу межклеточного
вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях. Полипептидная
цепь коллагена включает 1000 амино-
кислот и состоит из повторяющегося триплета [Гли-А-В],где А и В – любые,
кроме глицина аминокислоты. В основ-
ном это аланин, его доля составляет 11%, доля пролина и гидроксипролина –
21%. Таким образом, на оставшиеся
аминокислоты приходится всего 33%. Структура пролина и гидроксипролина
не позволяет образовать а-спиральную
структуру, из-заэтого образуется левозакрученная спираль, где на один виток
приходится 3 аминокислотных остатка. Гидроксилирование пролина осуществляет фермент пролилгидроксилаза, железо-содержащийфермент, для его полноценной работы необходим витамин С (аскорбиновая кислота). Недостаточность аскорбиновой кислоты в пище обуславливает возникновение цинги. Приматы и морские свинки утратили способность синтезировать аскорбиновую кислоту и, поэтому, должны получать ее с пищей. Являясь сильным вос-
становительным агентом, аскорбиновая кислота предохраняет от инактивации пролилгидроксилазу, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезированный в отсутствие аскорбиновой кислоты, оказывается недогидроксилированным и не может образовывать нормальные по структуре волокна, что приводит к поражению кожи и ломкости сосудов.
Молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлагена (длина=ЗОО нм, d=1,6 нм). Полипептидные
цепи прочно связаны между собой через ε-аминогруппыостатков лизина. Тропокол-
лаген формирует крупные коллагеновые фибриллы (d=10-300нм). Фибриллы очень прочны, они прочнее стальной проволоки равного сечения. Поперечная исчерчен-
ность фибриллы обусловлена смещением молекул тропоколлагена друг относи-
тельно друга на 1/4 их длины.
Вкоже фибриллы образуют нерегулярно сплетенную и очень густую сеть –
выделанная кожа представляет собой почти чистый коллаген.
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-концамежду Гли и Лей.
Врезультате распада коллагена образуется гидроксипролин. При поражении
соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидро-
ксипролина возрастает и имеет диагностическое значение. По мере старения организма в тропоколлагене образуется все большее число поперечных связей, что де-
studfiles.net
Альбумины и глобулины.
Альбумины - простые белки; входят в состав животных и растительных тканей; содержатся в белке яиц, сыворотке крови, молоке, в семенах растений. Растворимы в воде, солевых растворах, кислотах и щелочах. Примерно 75-80% осмотического давления белков сыворотки крови приходится на альбумины; еще одна их функция - транспорт жирных кислот.
Глобулины - группа животных и растительных белков, широко распространённых в природе. Относятся к глобулярным белкам. Растворимы в слабых растворах нейтральных солей, разбавленных кислотах и щелочах. Глобулины, представленные a-фракцией, содержатся в крови в комплексе с билирубином и с липопротеинами высокой плотности. Фракция β-глобулинов включает протромбин, являющийся предшественником тромбина - белка, участвующего в свертывании крови. Фракция g-глобулинов является наиболее гетерогенной. Важнейшими g-глобулинами являются иммуноглобулины.
Отношение альбумин/глобулин имеет диагностическое значение: в норме оно близко к 2, а при воспалительных заболеваниях — уменьшается.
Протамины и гистоны.
Протамины – низкомолекулярные белки в ядрах сперматозоидов у рыб и птиц. Они обладают содержат 60-85% аргинина и обладают основными свойствами. Хорошо растворяются в воде, кислой и нейтральной среде. Осаждаются щелочами. В ядрах клеток ассоциируются с ДНК.
Гистоны также являются небольшими белками основного характера. В их состав входят лизин и аргинин, содержание которых не превышает 20-30%. Существует пять различных типов гистонов: h2, h3A, h3B, h4 и h5. Эти белки находятся в основном в ядрах клеток. Они принимают участие в структурной организации хроматина.
Проламины и глютелины.
Проламины - белки растительного происхождени. Содержат 20-25% глутаминовой кислоты и 10-15% пролина. Растворимы в 60-80% водном растворе этанола, в то время как все остальные простые белки в этих условиях обычно выпадают в осадок.
Глютелины - простые белки, содержатся в семенах злаков, в зелёных частях растений. Для них характерно высокое содержание глутаминовой кислоты и наличие лизина. Растворимы в разбавленных растворах щелочей. Глютелины - запасные белки.
СЛОЖНЫЕ БЕЛКИ
1. Хромопротеины(от греч. chroma - краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины и флавопротеины. Они участвуют в таких процессах, как дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
К группе гемопротеинов относятся гемоглобин, миоглобин, цитохромы, каталаза, пероксидаз. Все они содержат железопорфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции. Видовые различия гемоглобина обусловлены глобином.
Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем- пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX (рис. 5). В центре гема расположен атом железа, связанный с двумя атомами азота ковалентно и с двумя другими - координационными связями. Гем «обернут» одной полипептидной цепью. В молекуле гемоглобина взрослого человека НbА (от англ. adult- взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин (рис. 6). Две α-цепи содержат по 141 аминокислотному остатку, две β-цепи - по 146.
 | 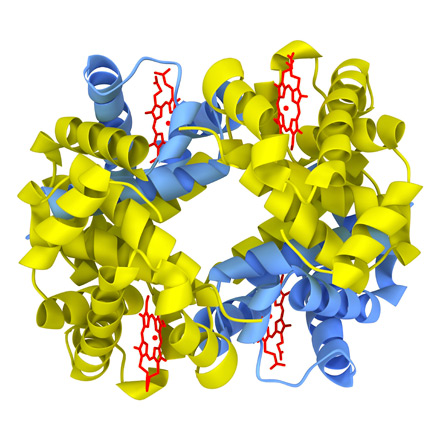 |
| Рис. 5. Гем | Рис. 6. Гемоглобин |
В крови взрослого человека присутствуют также гемоглобин НbА2 (2α, 2δ цепи, 2,5%) и НbA3 (менее 1%, отличается строением b-цепи).
Известен фетальный гемоглобин (гемоглобин новорожденных) HbF, состоящий из 2 α- и 2 γ-цепей. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Кровь новорожденного содержит до 80% HbF, к концу 1-го года жизни он почти целиком заменяется на НbА.
Болезни гемоглобинов (более 200) называют гемоглобинозами.
1. Гемоглобинопатии, в основе которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов мутантных гемоглобинов.
Аномальные гемоглобиныразличаются по физико-химическим свойствам (электрофоретическая подвижность, растворимость, изоэлектрическая точка, сродство к кислороду).
Классический пример гемоглобинопатии - серповидно-клеточная анемия, распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. Химический дефект сводится к замене глутаминовой кислоты в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. HbS после отдачи кислорода в тканях превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде веретенообразных кристаллов. Они деформируют клетку и приводят к гемолизу. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии. Болезнь протекает остро, и дети часто умирают в раннем возрасте.
2. Талассемии - группа заболеваний с наследственным нарушением синтеза одной из цепей глобина. Различают α- и β-талассемии. Гемоглобинопатия Н - один из вариантов a-талассемии - проявляется гемолитической анемией, выпадением в осадок гемоглобин Н, увеличением селезенки, тяжелыми костными изменениями.
3. Железодефицитные анемии - нарушение синтеза гемоглобина вследствие дефицита железа. Основными причинами являются кровопотери и недостаток богатой гемом пищи - мяса и рыбы.
Похожие статьи:
poznayka.org











